题目内容
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
①A的电子式是______
②加热条件下A与B在溶液中反应的离子方程式______
③C中含有的化学键类型为:______
④铝可以与B的某溶液反应,写出此反应的离子方程式______.
①A的电子式是______
②加热条件下A与B在溶液中反应的离子方程式______
③C中含有的化学键类型为:______
④铝可以与B的某溶液反应,写出此反应的离子方程式______.

如果A、B、C、D均是10电子粒子,结合10电子微粒的结构性质特征判断为:A为NH4+,B为OH-,C为NH3,D为H2O,则
①A为NH4+,为复杂阳离子,电子式为

,故答案为:

;
②NH4+在碱性条件下加热生成NH3,反应的离子方程式为NH4++OH-
NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O;
③C为NH3,只含有N-H键,为非金属元素形成的共价键,故答案为:共价键;
④Al可与强碱反应生成AlO2-和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
①A为NH4+,为复杂阳离子,电子式为

,故答案为:

;
②NH4+在碱性条件下加热生成NH3,反应的离子方程式为NH4++OH-
| ||
| ||
③C为NH3,只含有N-H键,为非金属元素形成的共价键,故答案为:共价键;
④Al可与强碱反应生成AlO2-和H2,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知A、B、C、D是原子序数依次增大的短周期主族元素,A、B、C分别在不同周期,A与C同主族,B的一种单质能使带火星的木条复燃,A、C、D三种原子的最外层电子数之和为6.下列说法不正确的是( )
| A、A的原子半径比B的小 | B、B与C形成的化合物只有一种 | C、C在化合物中呈+1价 | D、D单质的晶体可用作半导体材料 |
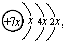 ,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.
,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.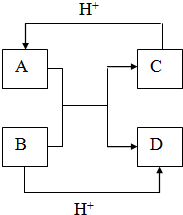 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.