题目内容
17.A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中电负性最大.(1)试推断A、B、C、D四种元素的名称和符号.
A氧、O
B钙、Ca
C钠、Na
D氯、Cl
(2)写出C和D的最高价氧化物对应的水化物反应的离子方程式H++OH-=H2O
(3)A和B形成的1mol化合物溶于水放出653kJ的热量,请写出热化学方程式CaO(s)+H2O(l)=Ca(OH)2(aq)△H=-653kJ/mol.
分析 A、B、C、D四种元素,已知A元素是自然界中含量最多的元素,则A为O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子之和,其核外电子数为20,则B是Ca元素;C元素是第3周期第一电离能最小的元素,则C为Na元素;D元素在第3周期中电负性最大,则D为Cl元素,据此进行解答.
解答 解:A、B、C、D四种元素,已知A元素是自然界中含量最多的元素,则A为O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子之和,其核外电子数为20,则B是Ca元素;C元素是第3周期第一电离能最小的元素,则C为Na元素;D元素在第3周期中电负性最大,则D为Cl元素,
(1)根据分析可知,A、B、C、D四种元素的名称和符号分别为:A:氧、O,B:钙、Ca,C:钠、Na,D:氯、Cl,
故答案为:A:氧、O;B:钙、Ca;C:钠、Na;D:氯、Cl;
(2)C和D的最高价氧化物对应的水化物分别为NaOH和高氯酸,二者发生中和反应,反应的离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(3)A和B形成的化合物为CaO,1mol CaO溶于水生成氢氧化钙,放出653kJ的热量,该反应的热化学方程式为:CaO(s)+H2O(l)=Ca(OH)2(aq)△H=-653kJ/mol,
故答案为:CaO(s)+H2O(l)=Ca(OH)2(aq)△H=-653kJ/mol.
点评 本题考查了位置结构与性质的关系及综合应用,题目难度中等,正确推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
5.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:Y的离子>Z的离子>M的离子>X的离子 | |
| C. | YX2、M2Y都含有极性键 | |
| D. | Z元素的最高价氧化物的水化物的化学式为H2ZO4 |
12.各周期包含的元素为( )
| A. | 2、8、18、32、72、98 | B. | 2、8、8、18、18、32 | C. | 2、8、8、18、32、32 | D. | 2、8、18、32、32、72 |
2.氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是( )
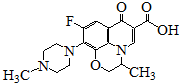

| A. | 能发生加成、取代反应 | |
| B. | 一定条件下,1mol该物质最多消耗5mol H2 | |
| C. | 分子内共有19个氢原子 | |
| D. | 分子内共平面的碳原子多于6个 |
7.下列叙述正确的是( )
| A. | 用铂丝蘸取某白色晶体,放在无色的灯焰上灼烧,火焰呈黄色,说明该固体一定不含钾盐 | |
| B. | 某溶液中加入AgNO3溶液,再加入足量稀HNO3仍有白色沉淀,说明溶液中一定有Cl- | |
| C. | 某溶液中加入BaCl2溶液和足量稀HCl后,仍有白色沉淀,则原溶液中一定有SO42- | |
| D. | 某溶液中加入NaOH溶液,将湿润的红色石蕊试纸靠近试管口无颜色变化,说明原溶液中一定无NH4+ |