题目内容
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
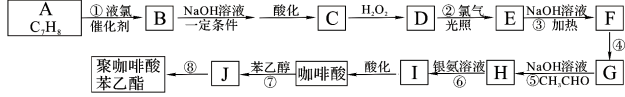
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

【答案】(1) sp3;60;(2)![]() ;As>Se>Ge;(3)PH3;
;As>Se>Ge;(3)PH3;
(4)三角锥形;< ;S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短;
(5)GaAs; (其他合理答案均可)
(其他合理答案均可)
【解析】
试题分析:(1)氮原子与周围的三个N原子相连,含有一个孤电子对,采取sp3杂化,N4是正四面体结构,N-N键的键角为60,故答案为: sp3;60;
(2)As是33号元素,位于第四周期第ⅤA族,基态砷原子的价电子排布图为![]() ,砷是4p为半充满结构,较为稳定,与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge,故答案为:
,砷是4p为半充满结构,较为稳定,与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge,故答案为:![]() ;As>Se>Ge;
;As>Se>Ge;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。P的非金属性比N弱,对孤对电子的吸引力弱,因此和过渡金属更容易形成配合物的是PH3,故答案为:PH3;
(4)SCl3+中价电子对个数=σ键个数+孤电子对个数=3+![]() (6-1-3)=4,故S以sp3杂化轨道同Cl形成共价键,含1对孤电子对,所以为三角锥形结构;S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短,故答案为:三角锥形;< ;S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短;
(6-1-3)=4,故S以sp3杂化轨道同Cl形成共价键,含1对孤电子对,所以为三角锥形结构;S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短,故答案为:三角锥形;< ;S 原子半径小于P原子半径故 S-Cl 键要比 P-Cl 键短;
(5)晶胞中Ga原子数为6×![]() +8×
+8×![]() =4,As原子数为4,则砷化镓的化学式为GaAs;
=4,As原子数为4,则砷化镓的化学式为GaAs;
设晶胞的边长为xpm,则ρ=![]() =
= ,解得x=
,解得x= pm;b位置黑色球与a位置白色球的距离为晶胞体对角线的
pm;b位置黑色球与a位置白色球的距离为晶胞体对角线的![]() ,因此b位置黑色球与a位置白色球的距离=
,因此b位置黑色球与a位置白色球的距离=![]() ×
× pm,故答案为:GaAs;
pm,故答案为:GaAs; 。
。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案