题目内容
4.已知:①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
②C(s)+$\frac{1}{2}$2O2(g)═CO(g)△H=-110.5kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
④H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
⑤H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
(1)上述反应中,反应物的总能量高于生成物的总能量的是②③④⑤(填序号);
(2)用一定量水蒸气通过炽热的炭层后,测得收集到的水煤气体积为22.4L(标准状况下),则该反应过程中吸收的热量为65.65KJ;
(3)将2.4g炭转化为水煤气,再将水煤气完全燃烧生成气态物质,整个过程的热效应总和为-78.7kJ•mol-1;
(4)欲用燃烧法测定某水煤气(其成分为CO和H2)中CO的体积分数,实验时需要测定的数据是第一个碱石灰增加的质量(如m g);
(5)NO和CO的反应的热化学方程式可以表示为2NO(g)+2CO(g)═2CO2(g)+N2(g),该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO和CO转化成无害物质排出,上述反应在使用催化器后,K值将不变(填“增大”“减小”或“不变”).
分析 (1)反应物的总能量高于生成物的总能量即为放热反应;
(2)根据C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1,则测得收集到的水煤气体积为22.4L(标准状况下)即生成CO和H2各0.5moL,据此计算;
(3)①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
④H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
根据盖斯定律①+③+④计算;
(4)取一定量的混合气体(如标况下V L)充分燃烧,将产物依次通过浓硫酸、碱石灰、碱石灰,后一个碱石灰是防止空气中的二氧化碳和水蒸气进入.测第一个碱石灰增加的质量(如m g),则CO的体积分数为$\frac{\frac{m}{44×22.4}}{V}$据此分析;
(5)催化剂只改变反应速率,不改变平衡移动.
解答 解:(1)反应物的总能量高于生成物的总能量即为放热反应,则放热反应△H<0,所以上述反应中,反应物的总能量高于生成物的总能量的是②③④⑤,故答案为:②③④⑤;
(2)因为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1,则测得收集到的水煤气体积为22.4L(标准状况下)即生成CO和H2各0.5moL,所以该反应过程中吸收的热量为131.3×0.5=65.65KJ,故答案为:65.65KJ;
(3)①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
④H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
根据盖斯定律①+③+④得C(s)+O2(g)═CO2(g)△H=+131.3-283.0-241.8=-393.5kJ•mol-1,所以2.4g炭转化为水煤气,再将水煤气完全燃烧生成气态物质,整个过程的热效应总和为$\frac{2.4}{12}$×(-393.5)=-78.7kJ•mol-1,故答案为:-78.7kJ•mol-1;
(4)取一定量的混合气体(如标况下V L)充分燃烧,将产物依次通过浓硫酸、碱石灰、碱石灰,后一个碱石灰是防止空气中的二氧化碳和水蒸气进入.测第一个碱石灰增加的质量(如m g),则CO的体积分数为$\frac{\frac{m}{44×22.4}}{V}$,所以实验时需要测定的数据是第一个碱石灰增加的质量(如m g),故答案为:第一个碱石灰增加的质量(如m g);
(5)催化剂只改变反应速率,不改变平衡移动,所以使用机动车尾气催化转化器,可以使尾气中的NO和CO转化成无害物质排出,上述反应在使用催化器后,K值将不变,故答案为:不变.
点评 本题考查知识点较多,注重对吸放热反应的判断,反应热的计算以及催化剂对化学平衡移动的影响等,题目难度中等,(4)为学生解答的易错点和难点.

| A. | NH3 | B. | NO2 | C. | SO2 | D. | HCl |
| A. | 工业上常使用过量的空气,目的是为了使SO2的转化率达100% | |
| B. | 工业上选用V2O5作该反应的催化剂,目的是为了加快化学反应速率 | |
| C. | 工业上常选用常压,原因是增大压强不能改变该反应的化学反应速率 | |
| D. | 升高温度可以加快反应速率,所以在工业生产中该反应温度越高越好 |
| A. | O2被还原 | |
| B. | 该反应是置换反应 | |
| C. | NH3是氧化剂 | |
| D. | 若有17gNH3参加反应,则反应中转移的电子数为10 mol |
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |
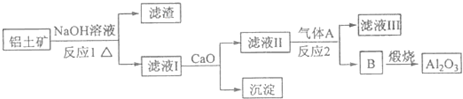

 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,