题目内容
钠、氯及其化合物有如下转化关系,请按要求填空:
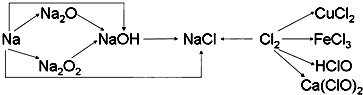
(1)金属钠的密度比水
(2)Na2O2是
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为
(4)漂白粉的有效成份是

(1)金属钠的密度比水
小
小
,实验室中金属钠通常保存在煤油
煤油
中.一小块金属钠投入水中的反应方程式是2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.(2)Na2O2是
淡黄
淡黄
色的固体,Na2O2的重要用途是做呼吸面具
做呼吸面具
,有关反应的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
.(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)漂白粉的有效成份是
Ca(ClO)2
Ca(ClO)2
(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.分析:(1)钠的密度小于水但大于煤油,钠极易和水、氧气反应,但和煤油不反应,钠和水反应生成氢氧化钠和氢气;
(2)过氧化钠是淡黄色固体,易和二氧化碳、水反应生成氧气;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)漂白粉的有效成分是次氯酸钙,碳酸的酸性大于次氯酸,根据强酸制取弱酸分析.
(2)过氧化钠是淡黄色固体,易和二氧化碳、水反应生成氧气;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)漂白粉的有效成分是次氯酸钙,碳酸的酸性大于次氯酸,根据强酸制取弱酸分析.
解答:解:(1)钠的密度小于水但大于煤油,钠极易和水、氧气反应,但和煤油不反应,所以可以保存在煤油中,钠和水反应生成氢氧化钠和氢气,反应方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:小;煤油;2Na+2H2O=2NaOH+H2↑;
(2)过氧化钠是淡黄色固体,易和二氧化碳、水反应生成氧气,所以过氧化钠的重要用途是做呼吸面具,过氧化钠和二氧化碳反应方程式为2Na2O2+CO2═2Na2CO3+O2,故答案为:淡黄;做呼吸面具;2Na2O2+CO2═2Na2CO3+O2;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为Cl2+2NaOH=NaCl+NaClO+H2O;
(4)漂白粉的有效成分是Ca(ClO)2,碳酸的酸性大于次氯酸,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
故答案为:小;煤油;2Na+2H2O=2NaOH+H2↑;
(2)过氧化钠是淡黄色固体,易和二氧化碳、水反应生成氧气,所以过氧化钠的重要用途是做呼吸面具,过氧化钠和二氧化碳反应方程式为2Na2O2+CO2═2Na2CO3+O2,故答案为:淡黄;做呼吸面具;2Na2O2+CO2═2Na2CO3+O2;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为Cl2+2NaOH=NaCl+NaClO+H2O;
(4)漂白粉的有效成分是Ca(ClO)2,碳酸的酸性大于次氯酸,次氯酸钙和二氧化碳、水反应生成碳酸钙和次氯酸,反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评:本题考查了钠及其化合物的性质,根据钠的性质、过氧化钠的性质、氯气的性质来分析解答即可,注意漂白粉的有效成分和主要成分的区别,为易错点.

练习册系列答案
相关题目


