题目内容
7.质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净后干燥并称重,二棒质量差为6.45g.则导线中通过的电子的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
分析 质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,形成原电池,负极是锌失电子生成锌离子进入溶液,质量减轻,正极是溶液中的铜离子得到电子生成铜,质量增重,总反应式为:Zn+Cu2+=Cu+Zn2+,负极减轻65g,正极增重64g,相差129g,根据关系式进行计算.
解答 解:质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,形成原电池,负极是锌失电子生成锌离子进入溶液,质量减轻,正极是溶液中的铜离子得到电子生成铜,质量增重,总反应式为:Zn+Cu2+=Cu+Zn2+,负极减轻65g,正极增重64g,相差129g,当二棒质量差为6.45g时,设参加反应的锌为xg,则$\frac{65}{x}$=$\frac{129}{6.45}$,x=3.25g,则锌的物质的量为$\frac{3.25g}{65g/mol}$=0.05mol,则导线中通过的电子物质的量为0.05mol×2=0.1mol,
故选A.
点评 本题考查了原电池工作原理,通过对电极反应的分析,利用差量法列关系式解题是关键,题目难度适中.

练习册系列答案
相关题目
17.与下列装置相关的说法中不正确的是( )
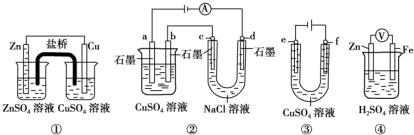

| A. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| B. | 装置②中b极析出6.4 g固体时,d极产生2.24 L H2 | |
| C. | 用装置③精炼铜时,f极为粗铜 | |
| D. | 装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
18.某元素X原子核外电子数等于核内中子数,取该元素单质2.8g与氧气充分作用,可得6g化合物XO2.该元素在周期表中的位置是( )
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
15.NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2.对此反应,下列叙述正确的是( )
| A. | 使用催化剂能加快反应 | B. | 升高温度能增大反应的速率 | ||
| C. | 改变压强对反应速率没有影响 | D. | 降低温度能加快反应 |
2.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 由金属A和金属B构成的原电池,电子由A流向B | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 常温时,A能从酸中置换出氢,而B不能 |
12.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46g有机物C2H6O中含有极性共价键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA | |
| C. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数为3NA | |
| D. | 标准状况下,1mol苯分子中含有碳碳双键的数目为3NA |
19.下列化学用语或模型表示正确的是( )
| A. | H2O2分子结构式:H-O-O-H | B. | 氚原子符号:${\;}_{1}^{2}$H | ||
| C. | Mg2+结构示意图: | D. | CO2的电子式: |
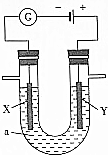 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答: