题目内容
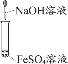
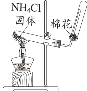
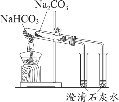
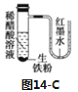
【题目】如图所示的8个装置属于原电池的是
A. ①④⑤B. ②③⑥C. ④⑥⑦D. ⑥⑦⑧
【答案】C
【解析】
根据原电池中有两个活泼性不同的电极、电解质溶液、形成闭合回路,自发进行的氧化还原反应,据此分析。
①该装置只有一个电极材料,所以不能形成原电池,故错误.
②该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
③两电极材料相同,所以不能形成原电池,故错误.
④该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑤酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
⑥该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑦该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑧该装置两电极间不能构成闭合回路,所以不能形成原电池,故错误。
综上,符合条件的有④⑥⑦。
答案选C。

【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
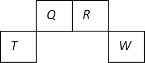
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
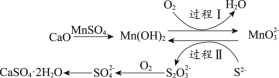
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。