题目内容
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
B
解析试题分析:碘的氧化性比较弱,所以与单质铁反应生成的是二价的铁。所以B选项是错误的
考点:考查卤素氧化性强弱的相关知识点

练习册系列答案
相关题目
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
下面有关氧化还原反应的叙述不正确的是 ( )
| A.氧化还原反应的本质是电子的转移 |
| B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高 |
| C.肯定有一种元素被氧化,另一种元素被还原 |
| D.在反应中不一定所有元素的化合价都发生变化 |
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝与稀盐酸的反应 | B.甲烷在氧气中的燃烧反应 |
| C.灼热的木炭与CO2反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
下列实验方案不能达到预期目的的是( )
| A.用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B.用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 |
| C.用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 |
| D.把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱 |
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO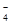 >Cl2>Fe3+ >I2 >Cl2>Fe3+ >I2 |
| B.FeCl3既有氧化性又有还原性 |
| C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3 |
| D.FeCl3能使湿润的淀粉碘化钾试纸变蓝 |