题目内容
在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 .(填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和890,0kJ?mol-1.
写出CO与H2反应生成CH4和CO2的热化学方程式: .
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)
HCOOCH3(g)△H=-29.1kJ?mol-1.科研人员对该反应进行了研究.部分研究结果如图所示: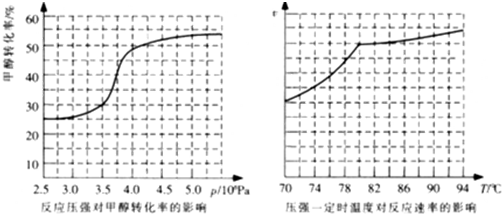
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 .
②实际工业生产中采用的温度是80℃,其理由是 .
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和890,0kJ?mol-1.
写出CO与H2反应生成CH4和CO2的热化学方程式:
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)
| 催化剂 | △ |

①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
分析:(1)恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),平衡标志是正逆反应速率相同,各组分含量不变;
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应;
(3)①依据自发进行的判断依据分析,△H-T△S<0;
②依据燃烧热写出反应的热化学方程式,结合盖斯定律计算得到;
(4)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应;
(3)①依据自发进行的判断依据分析,△H-T△S<0;
②依据燃烧热写出反应的热化学方程式,结合盖斯定律计算得到;
(4)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
解答:解:(1)在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),
a.反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故a正确;
b.容器中H2浓度与CO浓度相等不一定达到平衡,故b错误;
c.反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故c正确;
d.CO的生成速率与H2的生成速率相等,证明反应正向进行,故d错误;
故答案为:ac;
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为:CO-2e-+O2-=CO2,
故答案为:CO-2e-+O2-=CO2;
(3)①CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
②H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和890,0kJ?mol-1.
a、H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
b、CO(g)+
O2(g)=CO2 (g)△H=-283.0kJ?mol-1
c、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890,0kJ?mol-1
依据盖斯定律(b+a)×2-c得到2CO(g)+2H2(g)?CH4(g)+C02(g)△H=-247.6 kJ?mol-1
故答案为:2CO(g)+2H2(g)?CH4(g)+C02(g)△H=-247.6 kJ?mol-1;
(4)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
故答案为:3.5×106 Pa~4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
a.反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故a正确;
b.容器中H2浓度与CO浓度相等不一定达到平衡,故b错误;
c.反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故c正确;
d.CO的生成速率与H2的生成速率相等,证明反应正向进行,故d错误;
故答案为:ac;
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为:CO-2e-+O2-=CO2,
故答案为:CO-2e-+O2-=CO2;
(3)①CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
②H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ?mol-1、283.0kJ?mol-1和890,0kJ?mol-1.
a、H2(g)+
| 1 |
| 2 |
b、CO(g)+
| 1 |
| 2 |
c、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890,0kJ?mol-1
依据盖斯定律(b+a)×2-c得到2CO(g)+2H2(g)?CH4(g)+C02(g)△H=-247.6 kJ?mol-1
故答案为:2CO(g)+2H2(g)?CH4(g)+C02(g)△H=-247.6 kJ?mol-1;
(4)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
故答案为:3.5×106 Pa~4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
点评:本题考查平衡标志的判断,热化学方程式的计算应用,图象分析判断,注意掌握基础知识的掌握,题目难度中等.

练习册系列答案
相关题目

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0) CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1