题目内容
将20.02 mL PH=13的NaOH滴入0.1 mol/L HCl 20 mL中,此时溶液的![]() 和PH值各是多少?(要有过程,lg2=0.3)
和PH值各是多少?(要有过程,lg2=0.3)

(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一]探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,其缺陷是 _________________________________ ___。
(2)装置甲中反应的化学方程式是___________ ___。
(3)装置乙中的试剂是_____________________________________________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数
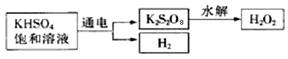
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98 mL、20.02 mL。
请回答:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略) (1)该装置设计上存在明显缺陷,其缺陷是 __________
(1)该装置设计上存在明显缺陷,其缺陷是 __________ _______________________ ___。
_______________________ ___。 (2)装置甲中反应的化学方程式是___________ ___。
(2)装置甲中反应的化学方程式是___________ ___。 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
 | |
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑) ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化; ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定; ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。 请回答:
请回答: (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。 (7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,其缺陷是 _________________________________ ___。
 (2)装置甲中反应的化学方程式是___________
___。
(2)装置甲中反应的化学方程式是___________
___。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数[来源:Z|xx|k.Com]
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
 ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
 请回答:
请回答:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________
___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________
___。
(7)原H2O2溶液中溶质的质量分数是__________
_____ ____。