题目内容
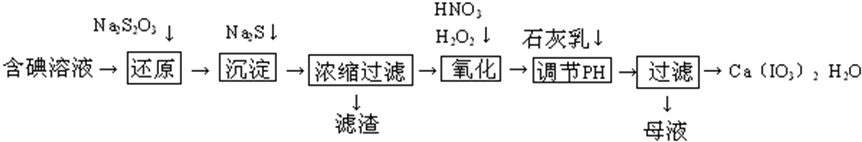
7.三聚氰胺(化学式:C3N6H6)是一种重要有机化工原料.下图是我国科技工作者研制的以尿素为原料生产三聚氰胺的工艺--“常压气相一步法联产纯碱新技术”:
已知:以尿素为原料生产三聚氰胺的原理是:6CO(NH2)2$\stackrel{一定条件下}{→}$C3N6H6+6NH3+3CO2
请回答:
(1)尿素的结构式为

(2)已知:产品1是本工艺的主产品,产品2是副产品,X为循环使用的物质,产品3为纯碱.写出各主要成份的化学式:产品1C3N3H6产品2NH4ClXCO2
(3)联氨系统沉淀池中发生的化学反应方程式为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓
(4)为了使母液中析出更多的产品2,常用的方法是A、D
A、加入固体NaCl B、加入固体NaHCO3 C、通入CO2气体 D、通入NH3
(5)若生产过程中有4%的尿素损耗,每吨尿素理论上可得副产品纯碱0.848吨(精确到0.001)
分析 (1)尿素(CO(NH2)2)分子中碳和氧原子间共用2对电子,碳原子和氢原子、氮原子之间共用一对电子;
(2)根据反应原理6CO(NH2)2 $\stackrel{一定条件下}{→}$C3N6H6+6NH3+3CO2及生产流程完成;
(3)联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶度积,析出碳酸氢钠晶体;
(4)根据反应方程式CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3 进行判断;
(5)设出二氧化碳的物质的量,然后根据反应原理计算出纯碱的质量.
解答 解:(1)尿素的分子CO(NH2)2中含有两个氮原子、1个氧原子、4个氢原子,碳和氧原子间共用2对电子,碳原子和氢原子、氮原子之间共用一对电子,结构式为: ,故答案为:
,故答案为: ;
;
(2)根据生产流程,分离器中分离出产品1为三聚氰胺(C3N3H6);联氨系统沉淀池中加入饱和食盐水和二氧化碳,析出碳酸氢钠晶体,母液主要是氯化铵溶液,利用母液得到产品2氯化铵;X是能够循环利用的二氧化碳,
故答案为:C3N3H6;NH4Cl;CO2;
(3)由于联氨系统沉淀池中,加入饱和食盐水和二氧化碳,大大降低了碳酸氢钠的溶度积,析出碳酸氢钠晶体,所以联氨系统沉淀池中发生的化学反应方程式为:
CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓;
(4)要从母液中析出更多的碳酸氢钠,根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3,可以向溶液中加入氯化钠或者通入二氧化碳气体,
故答案为:A、D;
(5)设生成nmol二氧化碳
根据反应6CO(NH2)2 $\stackrel{一定条件下}{→}$C3N6H6+6NH3+3CO2,
6×60 3mol
1t(1-4%) n
n(CO2)=$\frac{1}{2}$×n[CO(NH2)2]=0.5×$\frac{1×1{0}^{3}(1-4%)}{60}$=8mol,
由于氨气与二氧化碳的物质的量是2:1,反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3 中二氧化碳和氨气物质的量是1:1,氨气过量,所以应该按照二氧化碳的量计算生成纯碱的质量;根据反应CO2+NH3+NaCl+H2O→NH4Cl+NaHCO3 及碳原子守恒,生成纯碱的物质的量就等于尿素反应生成的二氧化碳的物质的量,纯碱的质量为:106×8=848g=0.848t,
故答案为:0.848.
点评 本题考查了合成三聚氰胺的方法,涉及的知识点较多、综合性较强,考查同学们灵活运用所学知识进行分析问题、解决问题的能力,注重了对知识的综合运用和迁移能力考查,题目难度中等.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.


 对叔丁基苯酚(
对叔丁基苯酚( )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下: .
. 分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化: .
.