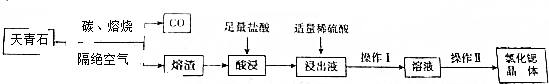
题目内容
14.下列反应的离子方程式不正确的是( )| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓HNO3:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O | |
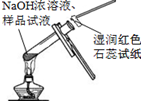
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
分析 A.硝酸根离子在酸性条件下能够氧化亚铁离子;
B.铜与浓硝酸反应生成硝酸铜、二氧化氮气体和水;
C.加热条件下铵根离子与氢氧根离子反应生成氨气;
D.氢氧化钠足量,铵根离子和碳酸氢根离子都参与反应.
解答 解:A.向Fe(NO3)2稀溶液中加入盐酸,反应氧化还原反应生成铁离子和一氧化氮气体,反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故A正确;
B.铜片与浓HNO3反应生成二氧化氮气体,反应的离子方程式为:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O,故B正确;
C.氯化铵浓溶液跟浓NaOH溶液混合后加热,二者反应生成氯化钠、氨气和水,反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故C正确;
D.碳酸氢铵溶液与足量的NaOH溶液混合后加热,反应生成碳酸钠、氨气和水,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3↑+2H2O,故D错误;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列指定反应的离子方程式正确的是( )
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
19.在下列各溶液中,一定可以大量共存的离子组是( )
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |
6.你认为减少酸雨产生的途径可采用的措施是:( )
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源.
①少用煤作燃料;②把工厂的烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源.
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
6.下列叙述正确的是( )
| A. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 清洁能源所用光电池的生产材料主要是用高纯度的二氧化硅 | |
| C. | 在医疗上氢氧化铝可用于治疗胃酸过多 | |
| D. | 漂白粉在使用时一定要加入一定量的盐酸才能起到漂白作用 |
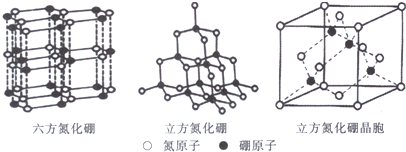
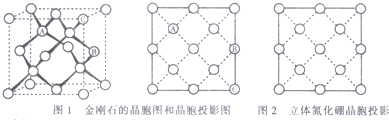
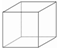 ,其六氯代物有3种;
,其六氯代物有3种;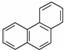 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种;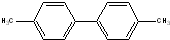 ),其二氯代物有16种.
),其二氯代物有16种.