题目内容
3.2 g Cu与50 mL浓H2SO4(足量)在加热条件下充分反应。(1)被还原的H2SO4的物质的量为_____________。
(2)若50 mL浓H2SO4中含溶质为a mol,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)=_____________0.5a mol(填“>”“<”或“=”)。
(3)把题干中反应后的溶液稀释至500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀20.27 g,求原浓H2SO4的物质的量浓度。
(1)0.05 mol (2)< (3)c(H2SO4)=18.4 mol·L-1
解析:(1)被还原的硫酸是参加反应的硫酸的物质的量的![]() ;
;
(2)浓H2SO4反应一段时间变成稀硫酸,稀硫酸不能和铜继续反应;
(3)n(![]() )=
)=![]() ×10=0.87 mol
×10=0.87 mol
n(H2SO4)=0.87 mol+0.05 mol=0.92 mol
c(H2SO4)=![]() =18.4 mol·L-1
=18.4 mol·L-1

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
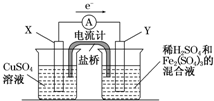 (2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(2010?宝鸡一模)(2011?长春质检)金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)