题目内容
下列有关化学用语的表示正确的是
A.中子数为20的氯原子符号为 |
| B.乙烯的结构简式为CH2CH2 |
| C.C60和石墨互为同位素 |
| D.NaHCO3的电离方程式为NaHCO3=Na++ HCO3- |
D
解析试题分析:A、中子数为20的氯原子质量数为37,左上角为37,错误;B、乙烯的结构简式为CH2=CH2,错误;C、C60和石墨互为同素异形体,错误;D、NaHCO3为强电解质,完全电离,电离方程式为:NaHCO3=Na++ HCO3-,正确。
考点:本题考查化学用语。

练习册系列答案
相关题目
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:
②常温下,pH=14的溶液中: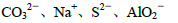
③室温下水电离的
④加入Mg能放出H2的溶液中: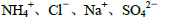
⑤使甲基橙变红的溶液中: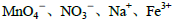
⑥室温下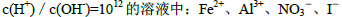
| A.①③⑥ | B.①②⑤ | C.②④⑤ | D.①③④ |
下列各组离子能在酸性溶液里大量共存,且溶液呈无色透明的是
| A.MnO4-、K+、Na+、SO42- |
| B.NH4+、Fe2+、SO42-、Cl- |
| C.Mg2+、SO42-、Cl-、Na+ |
| D.Na+、K+、HCO3-、SO42- |
下列有关离子反应或离子方程式的叙述中,正确的是( )
| A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
B.惰性电极电解氯化铝溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.镁与极稀硝酸反应生成硝酸铵的离子方程式为4Mg+6H++NO3—=4Mg2++NH4++3H2O |
| D.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2 |
下列离子在指定条件下一定能大量共存的是( )
| A.含有大量OH-的溶液中:CO32-、Cl-、F-、K+ |
| B.与铝反应产生氢气的溶液中:Na+、AlO2-、NO3-、HCO3- |
| C.含有大量Al3+的溶液中:K+、Na+、NO3-、ClO- |
| D.使甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是 ( )。
| A.硫酸溶液的体积为10 mL |
| B.b时刻溶液中SO42—的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH为13 |
| D.溶液的导电能力:c<d<b<a |
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:Na+、K+、N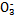 、NH3·H2O 、NH3·H2O |
| B.空气:C2H2、CO2、SO2、NO |
| C.氢氧化铁胶体:H+、K+、S2-、Br- |
D.高锰酸钾溶液:H+、Na+、S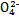 、葡萄糖分子 、葡萄糖分子 |
