题目内容
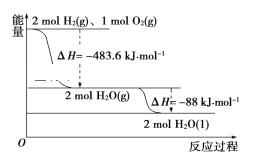
【题目】(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是________(填字母代号)。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极通入的气体为_______(填化学式);负极的电板反应式为_______。
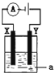
(3)电解原理在化学工业中有着广泛的应用。如图所示的电解池中,a为滴加了少量酚酞的NaCl溶液,X和Y是两块惰性电极板,则电解时,________(填“X”或“Y”)极附近的溶液变红,电解的离子方程式为_______。
【答案】C O2 H2+2OH--2e-=2H2O X 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【解析】
(1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应;
(2)负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,据此分析解答。
(1)能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,则
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,该反应是吸热反应,所以不能设计成原电池,故A不符合;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,该反应是不是氧化还原反应,所以不能设计成原电池,故B不符合;
C.C.2H2(g)+O2(g)=2H2O(1)△H<0,该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故C正确;
故答案选C;
(2)原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,则负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,正极上通入的是氧气,化学式为O2;
(3)用惰性电极电解氯化钠溶液时,电极Y与电源的正极相连,是阳极,氯离子放电生成氯气,阴极X上氢离子放电生成氢气,阴极周围水的电离平衡被破坏,导致阴极周围氢氧根离子的浓度大于氢离子浓度,所以在阴极X附近的溶液变红,电解的总反应式为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1