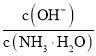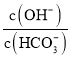题目内容
【题目】下列说法不正确的是( )
A.![]() 时,
时,![]() NaOH溶液和
NaOH溶液和![]()
![]() 混合,若溶液显酸性,则所得溶液中离子浓度可能为:
混合,若溶液显酸性,则所得溶液中离子浓度可能为:![]()
B.取![]() 的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入
的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入![]() 锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
C.用浓盐酸酸化的![]() 溶液与
溶液与![]() 反应,证明
反应,证明![]() 具有还原性:
具有还原性:![]()
D.含等物质的量的![]() 和
和![]() 的溶液中存在:
的溶液中存在:![]()
【答案】C
【解析】
A.若醋酸过量,溶于呈酸性,氢离子浓度可能大于钠离子,能够满足该离子浓度关系;
B.醋酸为弱酸,稀释后醋酸溶液中氢离子浓度较大;
C.酸性高锰酸钾能够氧化氯离子,干扰了实验结果;
D.根据混合液中的物料守恒判断。
![]() 时,
时,![]() NaOH溶液和
NaOH溶液和![]()
![]() 混合,若溶液显酸性,当氢氧化钠较少时,钠离子浓度小于氢离子浓度,则所得溶液中离子浓度可能为:
混合,若溶液显酸性,当氢氧化钠较少时,钠离子浓度小于氢离子浓度,则所得溶液中离子浓度可能为:![]() ,故A正确;
,故A正确;
B.取![]() 的盐酸和醋酸,醋酸的浓度较大,将100mL两溶液分别稀释2倍后,醋酸的电离程度增大,则稀释后醋酸溶液中氢离子浓度较大,加入
的盐酸和醋酸,醋酸的浓度较大,将100mL两溶液分别稀释2倍后,醋酸的电离程度增大,则稀释后醋酸溶液中氢离子浓度较大,加入![]() 锌粉后在相同条件下充分反应,醋酸与锌反应的速率大,故B正确;
锌粉后在相同条件下充分反应,醋酸与锌反应的速率大,故B正确;
C.用浓盐酸酸化的![]() 溶液与
溶液与![]() 反应,由于酸性高锰酸钾溶液能够氧化氯离子,干扰了实验,不能证明
反应,由于酸性高锰酸钾溶液能够氧化氯离子,干扰了实验,不能证明![]() 具有还原性,故C错误;
具有还原性,故C错误;
D.含等物质的量的![]() 和
和![]() 的溶液中,根据物料守恒可得:
的溶液中,根据物料守恒可得:![]() ,故D正确;
,故D正确;
故选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目