题目内容
【题目】高温条件下,Al和Fe2O3反应生成Fe和Al2O3。下列说法正确的是
A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性强于Fe
C. 反应中每生成1 mol Fe转移6×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
【答案】B
【解析】
A.铝热反应属于放热反应,反应物的总能量大于生成物的总能量,图象不符,选项A错误;B.Al和Fe2O3反应生成Fe和Al2O3,Al作还原剂,Fe是还原产物,所以Al的还原性强于Fe,选项B正确;C.反应中Fe元素的化合价从+3价降低到0价,所以反应中每生成1 mol Fe转移3×6.02×1023个电子,选项C错误;D.铝热反应中氯酸钾受热分解生成氧气,反应中KClO3不是催化剂,选项D错误。答案选B。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】乙酸乙酯是一种用途广泛的精细化工产品。某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程
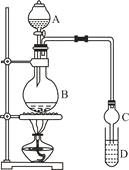
装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
(1)写出乙酸与乙醇发生酯化反应的化学方程式 。
(2)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 (填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(3)球形干燥管的主要作用是 。
(4)预先向饱和Na2CO3溶液中滴加几滴酚酞试液,目的是
。
Ⅱ.提纯方法:①将D中混合液转入分液漏斗进行分液。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(5)第①步分液时,选用的两种玻璃仪器的名称分别是 、 。
(6)第②步中用饱和食盐水、饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的 , , 。