题目内容
7.某混合物是由NaCl、MgCl2、AlCl3三种物质组成的,Na、Mg、Al三种元素的质量比为23:12:9.求:(1)NaCl、MgCl2、AlCl3的物质的量的比
(2)氯原子为1mol时,混合物的质量?
分析 (1)设Na、Mg、Al三种元素的质量分别23g、12g、9g,根据n=$\frac{m}{M}$计算各自物质的量,根据原子守恒计算NaCl、MgCl2、AlCl3的物质的量,进而计算三者物质的量之比;
(2)结合(1)中NaCl、MgCl2、AlCl3的物质的量之比,计算各物质的量的物质的量,再根据m=nM计算出混合物的质量.
解答 解:(1)设Na、Mg、Al三种元素的质量分别23g、12g、9g,则:
则n(NaCl)=n(Na)=$\frac{23g}{23g/mol}$=1mol,
n(MgCl2)=n(Mg)=$\frac{12g}{24g/mol}$=0.5mol,
n(AlCl3)=n(Al)=$\frac{9g}{27g/mol}$=$\frac{1}{3}$mol,
故NaCl、MgCl2、AlCl3的物质的量的比为1mol:0.5mol:$\frac{1}{3}$mol=6:3:2,
答:NaCl、MgCl2、AlCl3的物质的量的之比为6:3:2;
(2)设三者的物质的量分别为6x、3x、2x,则6x+3x×2+2x×3=1,解得x=$\frac{1}{18}$,则混合物的质量为:58.5g/mol×$\frac{1}{18}$×6mol+95g/mol×$\frac{1}{18}$×3mol+133.5g/mol×$\frac{1}{18}$×2mol=50.2g,
答:氯原子为1mol时,混合物的质量为50.2g.
点评 本题考查混合物有关计算、物质的量计算,题目难度不大,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
18.四个电解装置都以Pt做电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | BaCl2 | KOH |
| pH值变化 | 减小 | 增大 | 变大 | 不变 |
| A. | A | B. | B | C. | C | D. | D |
15.若溶液中由水电离产生的[OH-]=1×10-14 mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A. | Al3+,Na+,NO3-,Cl- | B. | K+,Na+,NO3-,Cl- | ||
| C. | K+,Na+,Cl-,AlO2- | D. | K+,NH4+,SO42-,NO3- |
2.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
12.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 标准状况下,22.4L乙烷含共价键数目为7NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液含OH-数目为0.2NA | |
| C. | 铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA | |
| D. | 常温常压下,6gHe含中子数为2NA |
19.一定温度下,在一个固定容积的密闭容器中加入3molH2和1molN2,建立如下平衡:N2(g)+3H2(g)?
2NH3(g)相同条件下,若向容器中再通入3mol H2和,1molN2再次达到平衡.则下列说法正确的是( )
2NH3(g)相同条件下,若向容器中再通入3mol H2和,1molN2再次达到平衡.则下列说法正确的是( )
| A. | NH3的百分含量不变 | B. | N2的体积分数增大 | ||
| C. | N2的转化率增大 | D. | NH3的百分含量增小 |
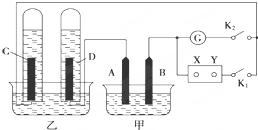 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.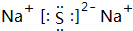 .
.