��Ŀ����
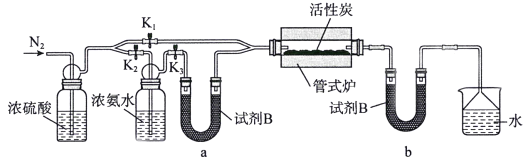
����Ŀ��Persi������LiTi2O4��������LiFePO4������������LiClO4��EC��PC��PVdF�������������Һ�������������Ӷ��ε�أ���ظ���ֻ����Li��ͨ����������Ӷ��ε�صĽṹʾ��ͼ��ͼ������˵������ȷ����
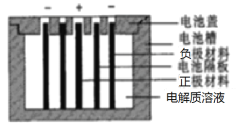
A.��������������������ȣ������·ת��1 mol e��ʱ������������Ϊ14g
B.�ŵ�ʱ��LiFePO4�缫�ĵ��Ƶ���LiTi2O4�ĵ���
C.�ŵ�ʱ���������Һ�е�Li����LiFePO4һ���ƶ�
D.���ʱ��LiFePO4�缫�ӵ�Դ������������������Ӧ
���𰸡�B
��������
�������֪��LiTi2O4��������LiFePO4��������ԭ��������ķ�Ӧ�ֱ��ǣ�
������Ӧ��![]() (
(![]() )
)
������Ӧ��Li(1��x)FePO4��![]() ��
��![]() = LiFePO4 (
= LiFePO4 (![]() )
)
A�����ݷ����������·ת��1 mol e��ʱ��������1 molLi��ΪLi�����������У��缫��������7g��������1 molLi����ΪLi�ڵ缫���������缫��������7g��������������Ϊ14g��A��ȷ��
B���ŵ�ʱΪԭ��أ�LiTi2O4��������LiFePO4�������������ĵ��Ƹߣ���LiFePO4�缫�ĵ��Ƹ���LiTi2O4�ĵ��ƣ�B����
C���ŵ�ʱ��������е��������������ƶ�������Li����LiFePO4һ���ƶ���C��ȷ��
D�����ʱ��ԭ��ص������ӵ�Դ��������Ϊ���ص�����������LiFePO4�缫�ӵ�Դ�����������ص���������������Ӧ��D��ȷ��
��ѡB��

 ���Ͱ�ͨ��ĩ���ϵ�д�
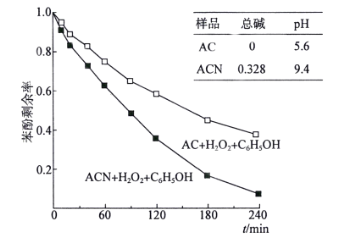
���Ͱ�ͨ��ĩ���ϵ�д�����Ŀ��������ȾԽ��Խ��Ϊ���ǹ�ע�����⣬�����е�NOx�����ѳ�(������)֮������ŷš�
��1��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺�� ��ӦCO(g)��H2O(g) ![]() H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯�����ʾ��
�¶�/�� | 400 | 500 | 830 | 1 000 |
ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�ٴ��ϱ������ƶϣ��˷�Ӧ��__________(����������������)�ȷ�Ӧ��
����830 ���£�����ʼʱ������ܱ������г���CO��H2O��Ϊ1 mol����ﵽƽ���CO��ת����Ϊ________��
��2��������β��ϵͳ��װ�ô�ת����������Ч����NOx��CO���ŷš�
��֪����2CO(g)��O2(g) ![]() 2CO2(g) ��H��566.0 kJ��mol1
2CO2(g) ��H��566.0 kJ��mol1
��N2(g)��O2(g) ![]() 2NO(g) ��H��+180.5 kJ��mol1
2NO(g) ��H��+180.5 kJ��mol1
��2NO(g)��O2(g) ![]() 2NO2(g) ��H��116.5 kJ��mol1
2NO2(g) ��H��116.5 kJ��mol1
�ش��������⣺
��CO��ȼ����Ϊ _________�� ��1 mol N2(g)��1 mol O2(g) �����л�ѧ������ʱ�ֱ���Ҫ����946 kJ��498 kJ����������1 mol NO(g) �����л�ѧ������ʱ�����յ�����Ϊ_________kJ��
��д��CO��NO2��ԭΪ���ʷ�Ӧ���Ȼ�ѧ����ʽΪ__________________________________________
��3�������������ϵĴ�ת����������������CO��NO2��ԭΪ���ʷ�Ӧ����һ���¶��£���һ������CO��NO2����2L�̶��ݻ��������У��ش��������⣺
�ٴӷ�Ӧ��ʼ��5min��������0.08mol N2����5min����(CO)=___________________molL1min1��
��25minʱ������Ũ�ȱ仯��ͼ��ʾ����ı������������___________(����ĸ���)��
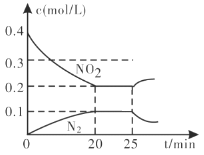
A.��С������� B.����NO2��Ũ�� C.�����¶� D.�����¶�