题目内容
【题目】电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
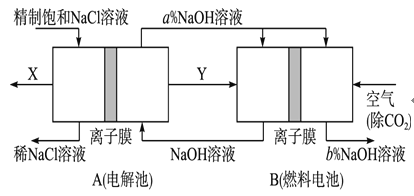
①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______b%(填>、=或<)
【答案】2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑2 △H - TΔS>0TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0使反应得以进行H2H2 + 2OH- -2e- = 2H2O<
2OH- + H2↑ + Cl2↑2 △H - TΔS>0TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0使反应得以进行H2H2 + 2OH- -2e- = 2H2O<
【解析】
(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
(2)溶液中电荷守恒;
(3)①根据焓判据和熵判据判断反应的方向;
②TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
根据盖斯定律,两式相加得TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1;
(4)①根据离子放电原理判断产物;突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2;
②再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的X必然为Cl2;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH-可知NaOH浓度增大.;
③氢氧燃料电池最后产生的是水,溶液稀释。
(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠,所以电解池的总反应为:2Cl- + 2H2O![]() 2OH- + H2↑ + Cl2↑ ;
2OH- + H2↑ + Cl2↑ ;
(2)当阴极产生1molH2时,溶液中产生2molOH- ,通过阳离子交换膜的Na+有2mol;
(3)①根据焓判据和熵判据判断反应的方向:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1,反应的△H1>0,ΔS<0,△H - TΔS>0。
②TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
根据盖斯定律,两式相加得TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g) + 2CO(g) △H =-45.5kJmol﹣1,反应△H<0,△H - TΔS<0,故反应可自发进行;
(4)①电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,故Y为H2;
②氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O,其负极反应表示为:H2 + 2OH- -2e- = 2H2O;
③由于燃料电池正极发生O2+4e-+2H2O=4OH-,燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b% 。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案