题目内容
在一定条件下,将物质的量之比为1∶3的N2和H2 102 g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5,则混合气体中NH3的质量为( )A.28.35 g B.32.64 g C.38.04 g D.65.28 g
D
解析:反应前m(N2)=102 g×1 mol×28 g·mol-1/(1 mol×28 g·mol-1+3 mol×2 g·mol-1)=84 g,则n(N2)=84 g/28 g·mol-1=3 mol,n(H2)=9 mol。
设达平衡时N2(或H2)的转化率为x,则
N2 + 3H2![]() 2NH3
2NH3
n(始) 3 mol 9 mol 0
n(转) 3x mol 9x mol 6x mol
n(平) (3-3x)mol (9-9x) mol 6x mol
则n(平总)=(3-3x) mol+(9-9x) mol+6x mol=(12-6x) mol
则12.5 g·mol-1=102 g/(12-6x) mol
解得x=0.64
则n(NH3)=6x mol=3.84 mol
m(NH3)=3.84 mol×17 g·mol-1=65.28 g。

练习册系列答案
相关题目
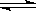 N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为
N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为