题目内容
已知氯元素的相对原子质量为35.5,自然界中的氯化钠晶体由23Na 和35Cl、37Cl构成,计算23.4g氯化钠晶体中含37Cl多少g?含 Na37Cl 多少g.分析:元素的相对原子质量为该元素各种核素的相对原子质量的平均值,原子的相对原子质量在数值上等于其质量数,先根据元素的相对原子质量计算3517Cl和3717Cl的原子个数比,再根据原子个数比计算3717Cl的质量.
解答:解:11.7g氯化钠中氯原子的物质的量=
=0.4mol;
氯元素的相对原子质量35.5是质量数分别为35和37的核素的平均值,可以采用十字交叉法计算其原子个数比;
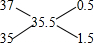 ,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,
,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,
所以含3717Cl的质量=0.4mol×
×37g/mol=3.7g;
含 Na37Cl的质量为:0.4mol×
×60g/mol=6.0g.
答:23.4g氯化钠晶体中含37Cl3.7g,含 Na37Cl 6.0g.
| 23.4g |
| 58.5g/mol |
氯元素的相对原子质量35.5是质量数分别为35和37的核素的平均值,可以采用十字交叉法计算其原子个数比;
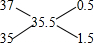 ,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,
,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,所以含3717Cl的质量=0.4mol×
| 1 |
| 4 |
含 Na37Cl的质量为:0.4mol×
| 1 |
| 4 |
答:23.4g氯化钠晶体中含37Cl3.7g,含 Na37Cl 6.0g.
点评:本题以计算核素的质量为载体考查了同位素原子个数的计算,难度不大,明确元素的相对原子质量为该元素各种核素的相对原子质量的平均值是解本题的关键.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目