题目内容
①在Fe3O4+4CO
3Fe+4CO2的反应中,
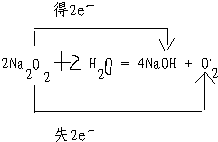
②用双线桥或单线桥标出电子转移的方向和数目:2Na2 O2+2H2O=4NaOH+O2↑.
| ||
Fe3O4
Fe3O4
是氧化剂,CO
CO
是还原剂,碳
碳
元素被氧化,铁
铁
元素被还原.②用双线桥或单线桥标出电子转移的方向和数目:2Na2 O2+2H2O=4NaOH+O2↑.
分析:①先找化合价变化的元素,然后判断氧化剂、还原剂、被氧化的元素、被还原的元素.
②先找化合价变化的元素,再标出电子转移的方向和数目.
②先找化合价变化的元素,再标出电子转移的方向和数目.
解答:解:①Fe3O4+4CO
3Fe+4CO2,元素化合价的变化分别是:Fe元素+2、+3→0价,C元素+2→+4价,所以氧化剂是
Fe3O4,还原剂是CO,碳元素被氧化,铁元素被还原,故答案为:Fe3O4;CO;碳;铁.
②该题化合价变化的元素都是过氧化钠中的O元素,所以过氧化钠既是氧化剂又是还原剂,电子转移数为2.故答案为:
| ||
Fe3O4,还原剂是CO,碳元素被氧化,铁元素被还原,故答案为:Fe3O4;CO;碳;铁.
②该题化合价变化的元素都是过氧化钠中的O元素,所以过氧化钠既是氧化剂又是还原剂,电子转移数为2.故答案为:

点评:注意:1、氧化性、还原性强弱取决于得失电子的难易,与得失电子的多少无关.
2、Fe3O4中的铁元素既有+2价又有+3价,是一种复杂的氧化物,计算电子得失时可用平均化合价计算.
2、Fe3O4中的铁元素既有+2价又有+3价,是一种复杂的氧化物,计算电子得失时可用平均化合价计算.

练习册系列答案
相关题目
 (2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( )
(2009?肇庆一模)一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2 (g)△H>0,以下说法中正确的是( ) (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: