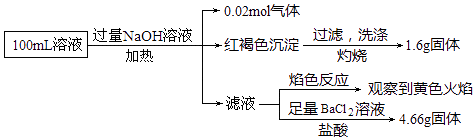
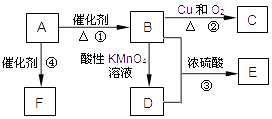
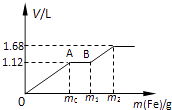
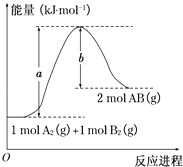
题目内容
【题目】氯元素的单质及其化合物在生产生活中应用极其广泛.请完成下列填空: 
(1)氯气性质探究
设计如图实验装置来制备并验证氯气的性质(部分夹持装置未画出).
(i)A中放置固体二氧化锰的装置名称是 .
(ii)装置B的作用是 .
(iii)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 .
(iv)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 .
(2)制备HClO
设计装置E代替如图的装置C,用于制备较高浓度的HClO溶液.在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙.
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) .
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有、(写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为molL﹣1(用含M、V的代数式表示).
【答案】
(1)圆底烧瓶;除去氯气中的氯化氢;变蓝色;Cl﹣+ClO﹣+2H+=Cl2↑+H2O
(2)Cl2+H2O?H++Cl﹣+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大;CaCl2;Ca(HCO3)2;![]() ﹣
﹣ ![]()
【解析】解:(1)氯气性质探究(i)装置A是制备氯气的发生装置,二氧化锰为固体和滴入的盐酸加热反应生成氯气,盛放二氧化锰的仪器为圆底烧瓶,所以答案是:圆底烧瓶;(ii)生成的氯气含有水蒸气和氯化氢,氯化氢极易溶于水,氯化钠溶液中氯离子抑制氯气和水的反应,通过饱和食盐水除去氯化氢气体杂质,所以答案是:除去氯气中的氯化氢;(iii)氯气有氧化性可以氧化碘化钾生成碘单质,2KI+Cl2=I2+2KCl,碘单质遇到淀粉变蓝色,所以答案是:变蓝色;(iv)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,加入酸发生归中反应生成氯气,反应的离子方程式为:ClO﹣+Cl﹣+2H+=Cl2↑+H2O,所以答案是:ClO﹣+Cl﹣+2H+=Cl2↑+H2O;(2)①该方案可以制得较高浓度HClO的原因是溶液中存在化学平衡:Cl2+H2O H++Cl﹣+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大,得到较高浓度HClO,
所以答案是:Cl2+H2OH++Cl﹣+HClO,碳酸钙与H+反应,使平衡向右移动,HClO浓度增大;
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,说明溶液中含有碳酸氢钙,是生成的二氧化碳和碳酸钙反应生成的碳酸氢钙,所以溶液中存在次氯酸、氯化钙、次氯酸钙;该小组同学测得反应中碳酸钙质量减少M g为碳酸钙,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),依据反应定量关系,CaCO3~Ca(HCO3)2~2CO2计算200ml溶液中生成二氧化碳的碳酸钙质量=( ![]() )mol×
)mol× ![]() ×100g/mol,则原溶液中含钙正盐的浓度=
×100g/mol,则原溶液中含钙正盐的浓度= ![]() =
= ![]() ﹣
﹣ ![]() ,
,
所以答案是:CaCl2、Ca(HCO3)2、 ![]() ﹣
﹣ ![]() .
.