题目内容
【题目】“题18图”为两物质的溶解度曲线。请回答:
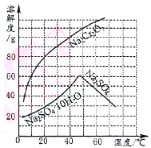
(1)50℃时,Na2Cr2O7的溶解度为________g;60℃时溶解度:Na2Cr2O7__________Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______________g (假设不含结晶水)。
【答案】110 > 50
【解析】
根据图像可知,Na2Cr2O7的溶解度随温度升高而增大,Na2SO4的溶解度随温度升高而减小。
(1)由曲线可知,50℃时,Na2Cr2O7的溶解度为110g;60℃时Na2Cr2O7的溶解度>Na2SO4的溶解度。
(2)由曲线可知,50℃时,Na2Cr2O7的溶解度为110g,10℃时Na2Cr2O7的溶解度为60g,50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7的质量为110g-60g=50g。

【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
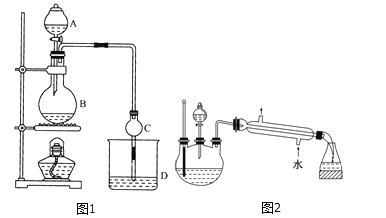
请回答:
(1)浓硫酸的作用是__________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是__________。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出__________;再加入无水硫酸钠除去水,然后进行__________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)__________。
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | I | II | III | IV | V | VI | VII |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________。
(2)④和⑧在周期表中的位置分别是________________;________________。
(3)②和③气态氢化物稳定性的大小顺序:________________(填化学式)。
(4)③⑧⑩的最高价含氧酸的酸性最强的是________________(填化学式)。
(5)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是__(填化学式),属于___(填“共价化合物”或“离子化合物”)。
(6)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____。
(7)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_____(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性