��Ŀ����
����Ŀ��2015��9�±����ĵ¹����ڳ�β���ŷ������¼������˹��ڵĹ�ע�����ڳ�β���г����д��ﵪ�����ͨ�����������������Һ�ķ��������ж��ĵ������ﻹԭ������Ⱦ�����ʡ�����ѡ����һ��Υ�����������ڿͻ�ƽʱ�ó�ʱ�������������ص�β������ϵͳ������ͨ����������һϵͳֻ��β���ŷż��ʱ������
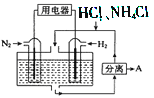
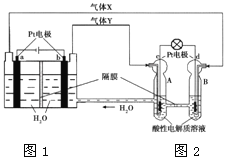
I��ͨ��NOx�������ɼ�������NOx�ĺ������乤��ԭ��ͼ����ͼ��д��NiO�缫�ĵ缫��Ӧʽ__________________��
������CO2��NH3Ϊԭ�Ͽɺϳ�����[��ѧʽΪCO(NH2)2]����֪��
��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H=-l59.5kJmol-1
��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.5kJmol-1
��H2O(l)=H2O(g) ��H=+44.0kJmol-1
��1��д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ____________��
��2�������½�2molNH3��1molCO2�����ݻ�Ϊ2L���ܱ������У���Ӧ����NH2CO2NH4(s)��2���Ӻ�ﵽƽ�⡣��ʱNH3��Ũ��Ϊ0.8mol/L����CO2�ķ�Ӧ����Ϊ________��NH3��ת������________��
����������һ���¶��¿ɷֽ�����NH3��NH3����ԭNxOy�������������������Ⱦ����֪��
��Ӧa��4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
��Ӧb��2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
��Ӧc: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
��1����ͬ�����£���Ӧa��2L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ�������Ӧ����N2������ʱ��仯��ͼ��ʾ������˵����ȷ����________________��
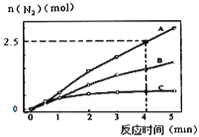
A���÷�Ӧ�Ļ�ܴ�С˳���ǣ�Ea(A)��Ea(B)��Ea(C)
B������ѹǿ��ʹ��Ӧ���ʼӿ죬����Ϊ�����˻���Ӱٷ���
C����λʱ����H-O����N-H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
D�����ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ��
��2�����ڷ�Ӧc��˵���ɼӿ췴Ӧ���ʵĴ�ʩ��_______________(��д2��)
��3�����º��������£���Ӧb�ﵽƽ��ʱ��ϵ��n(NO):n(O2):n(NO2)=2:1:2,��������������ʱ���ٳ���NO2���壬NO2�������_______(���������������С������������)��
���𰸡�I��NO-2e- +O2-=NO2��
II����1��2NH3(g)+CO2(g)=CO(NH2)2(s)++H2O(l) ��H=87.0kJ/mol����2��0.05mol/(L��min)��20%��
III����1��CD����2������NH3��NO2��N2��O2��Ũ�ȣ������¶ȣ�����ѹǿ�ȣ���3�����
��������
���������I��װ������ӵ�Դ����Ϊԭ��أ����缫�������õ������������Ӷ�����ԭ������Ϊ������������ԭ��Ӧ��NiO�缫��NOʧ���Ӻ������ӷ�Ӧ���ɶ���������NiOΪ���������Ե缫��ӦʽΪ��NO+O2--2e-=NO2���ʴ�Ϊ��NO+O2--2e-=NO2��
II����1����2NH3(g)+CO2(g)��NH2CO2 NH4(s)+l59.5kJmol-1����NH2CO2NH4(s)��CO(NH2)2(s)+H2O(g)-116.5kJmol-1����H2O(l)��H2O(g)-44.0kJmol-1�������Ȼ�ѧ����ʽ��˹���ɼ�����+��-���õ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol���ʴ�Ϊ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol��
��2��ƽ��ʱ��NH3��Ũ��Ϊ0.8mol/L����NH3�����ʵ���Ϊ0.8mol/L��2L=1.6mol��
2NH3(g)+CO2(g)![]() NH2CO2 NH4(s)
NH2CO2 NH4(s)
��ʼ(mol) 2 1 0
��Ӧ 0.4 0.2 0.2
ƽ�� 1.6 0.8
CO2�ķ�Ӧ����=![]() =
= =0.05mol/(L��min)��NH3��ת����=
=0.05mol/(L��min)��NH3��ת����=![]() ��100%=20%���ʴ�Ϊ��0.05mol/(L��min)��20%��
��100%=20%���ʴ�Ϊ��0.05mol/(L��min)��20%��
III����1��A����ͬʱ�������ɵĵ��������ʵ���Խ�࣬��Ӧ����Խ�죬���Խ�ͣ����Ը÷�Ӧ�Ļ�ܴ�С˳���ǣ�Ea(A)��Ea(B)��Ea(C)����A����B������ѹǿ��ʹ��Ӧ���ʼӿ죬����Ϊ�����˻��������������Ӱٷ������䣬��B����C����λʱ����H-O�����ѱ�ʾ�����ʣ�N-H�����ѱ�ʾ�����ʣ���λʱ����H-O����N-H�����ѵ���Ŀ���ʱ�������ĵ�NH3�����ĵ�ˮ�����ʵ���֮��Ϊ4��6������������֮�ȵ���4��6��˵����Ӧ�Ѿ��ﵽƽ�⣬��C��ȷ��D���÷�ӦΪ���ȷ�Ӧ�����ݾ��ȵ��ܱ������У���Ӧʱ�¶Ȼ����ߣ���K���С����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ�⣬��D��ȷ���ʴ�Ϊ��CD��
��2�����ڷ�Ӧc��˵���ɼӿ췴Ӧ���ʵĴ�ʩ������NH3��NO2��N2��O2��Ũ�ȣ������¶ȣ�����ѹǿ�ȣ��ʴ�Ϊ������NH3��NO2��N2��O2��Ũ�ȣ������¶ȣ�����ѹǿ�ȣ�
��3��һ�������£���ӦII2NO(g)+O2(g)![]() 2NO2(g)�ﵽƽ��ʱ��ϵ��n(NO)��n(O2)��n(NO2)=2��1��2����������������ʱ�������º��������У��ٳ���NO2���壬������ѹǿ������ԭ��ƽ����Ƚϣ�ƽ�������ƶ�����NO2���������ʴ�Ϊ�����
2NO2(g)�ﵽƽ��ʱ��ϵ��n(NO)��n(O2)��n(NO2)=2��1��2����������������ʱ�������º��������У��ٳ���NO2���壬������ѹǿ������ԭ��ƽ����Ƚϣ�ƽ�������ƶ�����NO2���������ʴ�Ϊ�����

 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д�