题目内容
15.将6mol A 气体和3mol B气体置于3L的密闭容器中,混合后发生如下反应:2A(g)+B(g)═2C(g).若经2s后测得B的浓度为0.4mol/L,下列说法正确的是( )| A. | 用物质A表示的反应速率为0.4mol/(L•s) | |
| B. | 用物质B表示的反应速率为0.4mol/(L•s) | |
| C. | 2 s时物质B的转化率为40% | |
| D. | 2 s时物质C的浓度为1.2 mol/L |
分析 起始A的浓度为:$\frac{6mol}{3L}$=2mol/L,B的浓度为:$\frac{3mol}{3L}$=1mol/L,经2s后侧得B的浓度为0.4mol•L-1,则B的浓度变化为0.6mol/L;根据化学反应速率等于单位时间内浓度的变化量及根据反应2A(g)+B(g)?2C(g),并利用三段式法计算,据此进行解答.
解答 解:起始A的浓度为:$\frac{6mol}{3L}$=2mol/L,B的浓度为:$\frac{3mol}{3L}$=1mol/L,经2s后侧得B的浓度为0.4mol•L-1,则B的浓度变化为:1mol/L-0.4mol/L=0.6mol/L,则:
2A(g)+B(g)?2C(g),
起始:2mol/L 1mol/L 0
变化:1.2mol/L 0.6mol/L 1.2mol/L
2s时:0.8mol/L 0.4mol/L 1.2mol/L
A.2s内用物质A表示的反应的平均速率为v(A)=$\frac{1.2mol/L}{2s}$=0.6mol•L-1•s-1,故A错误;
B.2s内用物质B表示的反应的平均速率为v(B)=$\frac{0.6mol}{2s}$=0.3mol•L-1•s-1,故B错误;
C.2s时物质B的转化率为:$\frac{0.6mol/L}{1mol/L}$×100%=60%,故C错误;
D.2s时物质C的浓度为1.2mol•L-1,故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,注意掌握化学平衡及其影响,明确三段式在化学平衡计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
5.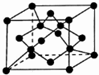 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化方式为sp杂化.
(4)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
(5)向T的硫酸盐溶液中逐渐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(6)X单质的一种晶胞如图所示,一个X晶胞中有8个X原子;若该晶体的密度为ρ g/cm3,何伏加德罗常数的值为NA,则晶体中最近的两个X原子核之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$(或$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$)cm(用含ρ、NA代数式表示).
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化方式为sp杂化.
(4)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的一种晶胞如图所示,一个X晶胞中有8个X原子;若该晶体的密度为ρ g/cm3,何伏加德罗常数的值为NA,则晶体中最近的两个X原子核之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$(或$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$)cm(用含ρ、NA代数式表示).
6.橙花醛是一种香料,结构简式为:(CH3)2C=CHCH2CH2C(CH3)=CHCHO.下列说法正确的是( )
| A. | 橙花醛不可以与溴发生加成反应 | |
| B. | 1mol橙花醛最多可以与2mol氢气发生加成反应 | |
| C. | 橙花醛可以发生银镜反应,分子结构存在顺反异构 | |
| D. | 橙花醛是乙醛的同系物 |
10.下列化学反应属于吸热反应的是( )
| A. | NH4Cl与Ba(OH)2•8H2O研磨 | B. | 生石灰溶于水 | ||
| C. | 镁与稀盐酸反应 | D. | 甲烷燃烧 |
20.下列物质属于烃的是( )
| A. | CH3CH2OH | B. | CH3Cl | C. | C2H2 | D. | CO2 |
7.决定化学反应速率的主要因素是( )
| A. | 反应物的性质 | B. | 反应温度 | C. | 催化剂 | D. | 反应物的浓度 |
4.下列物质属于共价化合物的是( )
| A. | MgCl2 | B. | (NH4)2SO4 | C. | C60 | D. | CO2 |
5.下列有机化合物属于链烃的是( )
| A. |  | B. |  | C. |  | D. |  |
 ⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.
⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.