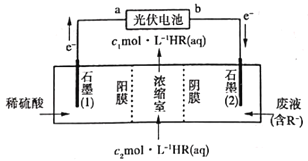
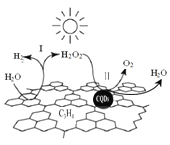
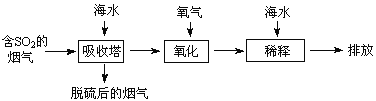
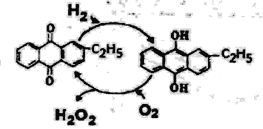
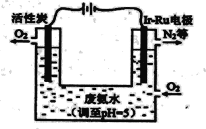
题目内容
【题目】CO2和CO混合气体共8mol,通入足量Na2O2中,并且用电火花持续引爆,充分反应后,剩余气体1mol,则固体增重为多少克?( )
A.56gB.168gC.224gD.196g
【答案】C
【解析】
Na2O2与CO在高温条件下不会反应,但如果体系中存在O2时,CO会先与O2反应生成CO2,CO2再与Na2O2反应生成O2和Na2CO3,整个反应过程中,O2相当于作催化剂,以此解答本题。
已知2Na2O2+2CO2=2Na2CO3+O2,当有O2存在时,不断用电火花引燃的情况下,CO被Na2O2完全吸收:Na2O2+CO![]() Na2CO3,因此最终余下的气体为O2,因CO2和CO混合气体共8mol,由原子守恒可知,最终消耗8molNa2O2、生成8mol Na2CO3,故最终固体增重8mol×[M(Na2CO3)-M(Na2O2)]=8mol×(106g/mol-78g/mol)=224g,
Na2CO3,因此最终余下的气体为O2,因CO2和CO混合气体共8mol,由原子守恒可知,最终消耗8molNa2O2、生成8mol Na2CO3,故最终固体增重8mol×[M(Na2CO3)-M(Na2O2)]=8mol×(106g/mol-78g/mol)=224g,
故答案为C。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-