题目内容
15.下列说法正确的是( )| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
分析 A.自发进行的氧化还原反应可以设计为原电池的化学反应;
B.化学键的形成要放出能量;
C.周期表中的元素大多是自然界存在的,但有些属于人造元素,如106号元素;
D.需要加热才能进行的化学反应不一定是吸热反应.
解答 解:A.能设计成原电池的反应必须是自发进行的、放热的氧化还原反应,故A错误;
B.化学键的形成要放出能量,所以原子组成分子一定释放出能量,故B正确;
C.周期表中的元素大多是自然界存在的,但有些属于人造元素,都是放射性元素,包括Tc、Pm、At、Np、Pu、Am、Cm、Bk、Cf、Es、Fm、Md、No、Lr、Rf、Db、Es、Bh、Hs、Mt和110、111、112号元素,故C错误;
D.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,故D错误;
故选B.
点评 本题考查了化学反应能量变化的分析判断以及原电池的设计等,变化过程实质分析是解题关键,题目较简单.

练习册系列答案
相关题目
5.化学与人类生活密切相关.关于下列物质的使用不合理的是( )
| A. | 二氧化硫常用于食品增白 | B. | 碳酸氢钠常用于焙制糕点 | ||
| C. | 醋酸常用于除去水壶内的水垢 | D. | 氢氧化铝常用于治疗胃酸过多 |
6.已知2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).是工业制H2SO4的一个重要的反应,控制此反应条件,使之向有利于生成SO3的反应方向进行,下列有关叙述错误的是( )
| A. | 使用催化剂(V2O5)可提高该反应的反应速率 | |
| B. | 定期抽走SO3,有利于提高SO3的产率 | |
| C. | 增大O2的浓度,有利于提高SO2的转化率 | |
| D. | 增大SO2的浓度,有利于提高SO2的转化率 |
3.决定化学反应速率的主要因素是( )
| A. | 催化剂 | B. | 温度、压强以及反应物的接触面 | ||
| C. | 反应物的浓度 | D. | 参加反应的物质本身的性质 |
20.既可以鉴别乙烷和乙烯,又可以用来除去乙烷中的乙烯的方法是( )
| A. | 通过足量NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni粉催化、加热条件下通入H2 | D. | 通入足量的KMnO4 酸性溶液 |

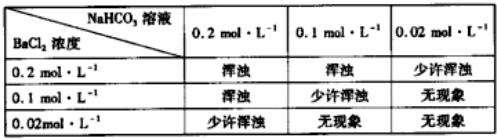
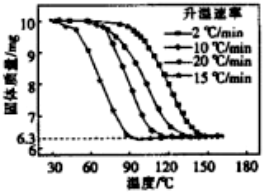
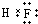 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.