��Ŀ����
 FeO(s) +CO(g)��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g)
FeO(s) +CO(g)��ƽ�ⳣ��ΪK1����Ӧ��Fe(s)+H2O(g) FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±�
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶�ʱK1��K2��ֵ���±�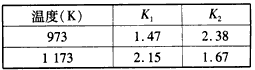
 CO(g)+H2O(g)��ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ_________��
CO(g)+H2O(g)��ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ_________��(2)�ں�ѹ�����У�����һ������CO2��H2�����¶�Ϊ1173 Kʱ�ﵽ��ѧƽ�⣬���������м���Ar����ﵽ��ƽ��ʱ��ƽ�ⳣ��K__________�����������С���� �����䡱������ʱCO2Ũ����ԭƽ��ʱ��Ũ����ȣ���________�����������С�����䡱����
(3)��֪
2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ/mol ��
2H2(g)+O2(g)=2H2O(g) ��H=-483.6 kJ/mol ��
��ӦCO2(g)+H2(g)
 CO(g)+H2O(g)�ġ�H=__________��
CO(g)+H2O(g)�ġ�H=__________��  ��
��
(2)���䣻��С
(3) +41.2 kJ/mol

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д���10�֣���1����ӦFe(s)+CO2(g)FeO(s)+CO(g) ��H1��ƽ�ⳣ��ΪK1
��ӦFe(s)+H2O(g)FeO(s)+H2(g) ��H2��ƽ�ⳣ��ΪK2
�ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
|
| 700�� | 900�� |
| K1 | 1��47 | 2��15 |
| K2 | 2��38 | 1��67 |
�ٷ�Ӧ CO2(g) + H2(g)CO(g) + H2O(g) ��H ��ƽ�ⳣ��K�����H= ���á�H1�͡�H2��ʾ����K= ����K1��K2��ʾ�����������������֪����ӦCO2(g)+ H2(g)
CO(g) + H2O(g)�� ��Ӧ������ȡ����ȡ�����
�����ж�CO2(g)+ H2(g)CO(g) + H2O(g)�ﵽ��ѧƽ��״̬�������� ������ţ���
A��������ѹǿ���� B�����������c(CO)����
C��v��(H2)= v��(H2O) D��c(CO)=c(CO2)
��2��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬������ӦFe(s)+CO2(g)FeO(s)+CO(g)��H > 0��CO2��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
�ٸ������·�Ӧ��ƽ�ⳣ��Ϊ ��������������CO2����ʼŨ��Ϊ2.0mol��L��1����ƽ��ʱCO2��Ũ�� mol��L��1��
�����д�ʩ����ʹƽ��ʱ������� ������ţ�
A�������¶� B������ѹǿ
C������һ������CO2 D���ټ���һ��������
��16�֣����ܱ������н��У�
��Ӧ�� Fe(s)+CO2(g) FeO(s)+CO(g) ��H1=" a" kJ��mol-1
FeO(s)+CO(g) ��H1=" a" kJ��mol-1
��Ӧ�� 2CO(g)+O2(g) 2CO2(g) ��H2=" b" kJ��mol-1
2CO2(g) ��H2=" b" kJ��mol-1
��Ӧ�� 2Fe(s)+O2(g) 2FeO(s) ��H3
2FeO(s) ��H3
��1����H3= ���ú�a��b�Ĵ���ʽ��ʾ��
��2����Ӧ�ٵĻ�ѧƽ�ⳣ������ʽK= ����֪500��ʱ��Ӧ�ٵ�ƽ�ⳣ��K=1.0���ڴ��¶���2L�ܱ������н��з�Ӧ�٣�Fe��CO2����ʼ����Ϊ2.0mol���ﵽƽ��ʱCO2��ת����Ϊ ��CO��ƽ��Ũ��Ϊ
��3��������ƽ����ϵ������700�棬�ٴδﵽƽ��ʱ��ϵ��CO��Ũ����CO2Ũ�ȵ���������a 0���>������<����=������Ϊ�˼ӿ컯ѧ��Ӧ������ʹ��ϵ��CO�����ʵ������ӣ�������������ʱ�����Բ�ȡ�Ĵ�ʩ�� ������ţ���
| A����С��Ӧ����� | B����ͨ��CO2 |
| C�������¶� | D��ʹ�ú��ʵĴ��� |
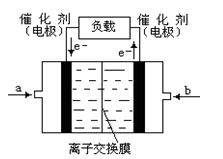
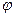 Ϊ�������CO������TΪ�¶ȣ���
Ϊ�������CO������TΪ�¶ȣ���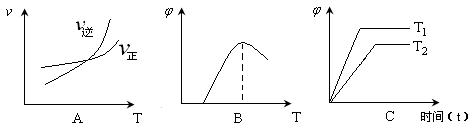
 FeO(s)+CO(g) ��H1��ƽ�ⳣ��ΪK1
FeO(s)+CO(g) ��H1��ƽ�ⳣ��ΪK1
 ������� ������ţ�
������� ������ţ�
