题目内容
硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =
—905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H =
—905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
△H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g)
△H = —1268 kJ/mol ②副反应
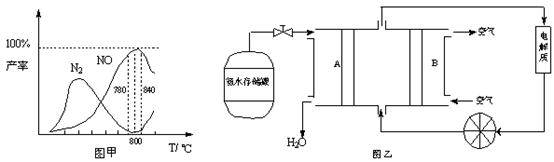
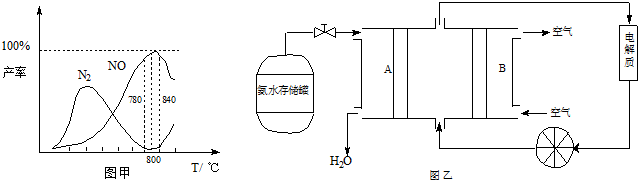
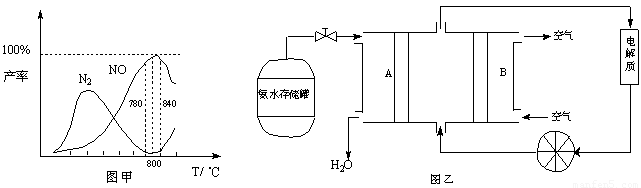
有关物质产率与温度的关系如甲图。
(1)由反应①②可知反应③N2(g) + O2(g) 2NO(g)的反应热ΔH= 。
2NO(g)的反应热ΔH= 。
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在 。
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 (填“正极”或“负极”),电极方程式为 。
(12分)(每空2分)(1) +181.5 kJ/mol(2) 780℃~840℃
(3)
抑制Fe3+的水解;Fe3++3H2O Fe(OH)3+3H+ (4) 2NH3+ClO—=N2H4+Cl—+H2O
Fe(OH)3+3H+ (4) 2NH3+ClO—=N2H4+Cl—+H2O
(5) 负极 2NH3—6e—+6OH—=N2+6H2O
【解析】
试题分析:(1)根据盖斯定律可知,(①-②)÷2即得到N2(g) + O2(g) 2NO(g),则该反应的反应热△H=(—905 kJ/mol+1268 kJ/mol)÷2=+181.5 kJ/mol。
2NO(g),则该反应的反应热△H=(—905 kJ/mol+1268 kJ/mol)÷2=+181.5 kJ/mol。
(2)由图甲可知,在温度为780℃~840℃时NO的产率最高,即工业上氨催化氧化生成 NO时,反应温度最好控制在780℃~840℃。
(3)因为在硝酸过量的条件下,能抑制铁离子的水解,反应的方程式时Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
(4)将NH3通入NaClO溶液中,可生成N2H4,这说明次氯酸钠时氧化剂,氨气时还原剂,所以反应的方程式是2NH3+ClO—=N2H4+Cl—+H2O。
(5)根据装置图可知,A电极是失去电子的,所以是负极,发生氧化反应,则电极反应式是2NH3—6e—+6OH—=N2+6H2O。
考点:考查反应热的计算、反应条件的控制、水解的应用以及电极反应式的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,在注重学生答题能力的同时,侧重对学生能力的培养和解题方法的指导与训练。意在巩固学生的基础,提高学生的应试能力和学习效率。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
① 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
4NO(g)+6H2O(g) △H = —905 kJ/mol ①主反应
② 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
2N2(g)+6H2O(g) △H = —1268 kJ/mol ②副反应
有关物质产率与温度的关系如甲图。
 |
(1)由反应①②可知反应③N2(g) + O2(g) ![]() 2NO(g)的反应热ΔH= ▲
2NO(g)的反应热ΔH= ▲
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在 ▲
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,
原因二: ▲ (用文字和离子方程式说明)。
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为 ▲ 。
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为 ▲ (填“正极”或“负极”),电极方程式为 ▲

 4NO(g)+6H2O(g)
△H = —905
kJ/mol ①主反应
4NO(g)+6H2O(g)
△H = —905
kJ/mol ①主反应