题目内容
H2S与浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是 H2SO4,HNO3的还原产物是NO,完成并配平这一反应的化学方程式_____________________________; 如果反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是_______L,将这些NO全部氧化并被水完全吸收,需标准状况下的O2__________L。
答案:3H2S + 8 HNO3 == 3 H2SO4 + 8NO + 4H2O ; 17.92 ; 13.44
提示:
提示:

V(NO)=2.4÷24×8mol×22.4L/mol=17.92L; 根据4NO+3O2+2H2O=4HNO3 ∴V(O2)= 17.92L×3/4=13.44L
|

练习册系列答案
相关题目
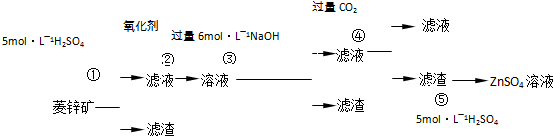
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.