题目内容
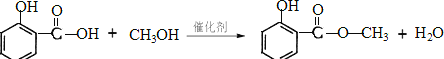
【题目】水杨酸甲酯是一种无色透明油状液体,相对分子质量为152,密度为1.184gcm﹣3,沸点223.3℃,熔点﹣86℃,微溶于水,易溶于有机溶剂,露置在空气中则易缓慢变色。由水杨酸和甲醇在浓硫酸存在条件下反应制得水杨酸甲酯(冬青油)的反应如下:

某学校的实验探究小组利用如图装置制备冬青油.步骤如下

①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为4.56g
试回答下列问题:
(1)装置中仪器a的作用是_______________;水应该从________(填“Ⅰ”或“Ⅱ”)处流入,仪器b的适宜规格为___________(填序号);
①10℃ ②50℃ ③150℃
(2)加入NaHCO3溶液的目的除了将冬青油中的甲醇、水杨酸、硫酸等除去外,还有___________;加入水震荡分层后,冬青油的粗产品在_______(填“上”或“下”)层;
(3)在本实验分离过程中,水层应该从分液漏斗的_________________(填“上口倒出”或“下口放出”);
(4)本次实验冬青油的产率是____________。
【答案】冷凝回流 Ⅱ ③ 降低冬青油在水中的溶解度 下层 上口倒出 60%
【解析】
(1)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计;
(2)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g/cm-3,比水溶液重;
(3)冬青油的粗产品的密度比水大,水层应从分液漏斗的上口倒出;
(4)结合反应定量关系计算理论量,产率=![]() ×100%。
×100%。
(1)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好,应从Ⅱ通入;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计,选择150℃的温度计;
故答案为:冷凝管,Ⅱ;③;
(2)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g/cm-3,比水溶液重,粗产品在下层;
故答案为:降低冬青油在水中的溶解度;下层;
(3)冬青油的粗产品的密度比水大,水层应从分液漏斗的上口倒出;
故答案为:上口倒出;
(4)结合反应定量关系计算理论量,
138 152
6.9g m
m=7.6g
产率=![]() ×100%=
×100%=![]() ×100%=60%。
×100%=60%。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案





