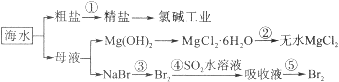
��Ŀ����
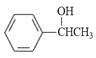
����Ŀ��Cl2���仯�����������������о��й㷺����;��25��ʱ����������ˮ�γ���������ˮ��ϵ������ϵ��Cl2(aq)��HClO��ClO���ֱ�����������ռ������������pH�仯�Ĺ�ϵ��ͼһ��ʾ��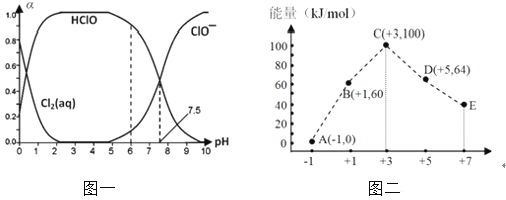
��1����֪HClO��ɱ��������ClO��ǿ����ͼһ��������������������ˮʱ��pH��7.5��pH��6ʱɱ��Ч��ǿ��������������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪ��
��2��ClO2��һ���ױ�ը��ǿ���������壬��һ�����õ���������������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡClO2 �� �÷�Ӧ�Ļ�ѧ����ʽΪ���������ѧ�����о�������������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2�ķ������÷�Ӧ�����ӷ�Ӧ����ʽΪ���˷����ŵ�������ҵ�ϻ����õ�ⷨ�Ʊ�ClO2 �� ��80��ʱ����Ȼ�����Һ�õ�NaClO3 �� Ȼ�������ᷴӦ�õ�ClO2����������NaClO3����������������������ɣ�����ClO3�C�ĵ缫��ӦʽΪ��
��3��һ�������£���ˮ��Һ�� 1 mol Cl�C��1mol ClOx�C��x=1��2��3��4����������С��ϼ۵Ĺ�ϵ��ͼ����ʾ���������Ƕȿ���C��D��E����ȶ����������������ӷ��ţ���B �� A + D��Ӧ���Ȼ�ѧ����ʽΪ�������ӷ��ű�ʾ����
���𰸡�
��1��pH=6ʱ��Cl2(aq)��H2O ![]() HClO��H����Cl�� �� HClO
HClO��H����Cl�� �� HClO ![]() H����ClO�� �� Cl2(g)
H����ClO�� �� Cl2(g) ![]() Cl2(aq)
Cl2(aq)
��2��Cl2+2NaClO2 == 2NaCl+2ClO2��C2O42����2ClO3����4H��==2ClO2����2CO2����2H2O����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ�����Cl����6e��+3 H2O ��6H����ClO3��
��3��ClO2����3ClO��(aq) �� 2Cl��(aq)��ClO3��(aq) ��H��-116kJ/mol
���������⣺��1��HClO��ɱ��������ClO-ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ͼ֪��pH=6ʱHClO�����ϸߣ�����pH=6ʱƯ��Ч���Ϻã�
���ȵ����ʴ���ƽ���״̬Ϊ������ˮ��Ӧ�����������ƽ�⣬Һ̬��������̬������ƽ��ȣ�����-��ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪCl2��aq��+H2OHClO+H++Cl-�� HClOH++ClO- �� Cl2��g��Cl2��aq����
���Դ��ǣ�pH=6ʱ��Cl2��aq��+H2OHClO+H++Cl- �� HClOH++ClO- �� Cl2��g��Cl2��aq����
��2��ClO2��һ���µ�����������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡClO2 �� ���ԭ���غ�͵����غ�д���÷�Ӧ�Ļ�ѧ����Cl2+2NaClO2=2NaCl+2ClO2 ��
��������Һ���ò����ƣ�Na2C2O4����ԭ��������ȡClO2 �� ͬʱ���ɶ�����̼����Ӧ�����ӷ���ʽΪC2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O��
����Ȼ�����Һʱ��������������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪCl--6e-+3 H2O=6H++ClO3- �� ��Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ�
���Դ��ǣ�Cl2+2NaClO2�T2NaCl+2ClO2��C2O42-+2ClO3-+4H+�T2ClO2��+2CO2��+2H2O����Ӧ�����ɵĶ�����̼��ϡ�����ã���������ClO2���������桢����İ�ȫ�ԣ����� Cl--6e-+3H2O=6H++ClO3-��
��3��ͼ�������֪������Խ��Խ���ã�+3�۵����������ΪClO2-��
B��A+C������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl- �� ��Ӧ��=��64kJ/mol+2��0kJ/mol��-3��60kJ/mol=-116kJ/mol�����Ը��Ȼ�ѧ��Ӧ����ʽΪ3ClO-��aq��=ClO3-��aq��+2Cl-��aq����H=-116kJ/mol��
���Դ��ǣ�ClO2-��3ClO-��aq��=2Cl-��aq��+ClO3-��aq����H=-116kJ/mol��

����Ŀ�����и��������У���������ͼ����һ��ת����ϵ��ѡ���ǣ� ��
X | Y | Z | |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu��OH��2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |

A.A
B.B
C.C
D.D