题目内容
5.KOH溶液中溶质质量分数为14%,加热蒸发掉100g水后变成溶质质量分数为28%的KOH溶液80mL,则后者溶液的物质的量浓度可能为( )| A. | 6 mol•L-1 | B. | 6.75 mol•L-1 | C. | 6.25 mol•L-1 | D. | 5 mol•L-1 |
分析 设14%KOH溶液的质量为m,根据溶质质量不变列方程计算溶液的质量,进而计算溶质的物质的量,根据c=$\frac{n}{V}$计算.
解答 解:设14%KOH溶液的质量为m,则:
m×14%=(m-100g)×28%,
解得m=200g,
m(KOH)=200g×14%=28g,
n(KOH)=$\frac{28g}{56g/mol}$=0.5mol,
c(KOH)=$\frac{0.5mol}{0.08L}$=6.25mol/L,
故选C.
点评 本题考查溶液浓度计算,涉及质量分数、物质的量浓度,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列物质属于纯净物的是( )
| A. | 矿泉水 | B. | 冰水混合物 | C. | 海水 | D. | 食盐水 |
16.下列物质中属于酯类的是( )
| A. | 石蜡油 | B. | 甘油 | C. | 酚醛树脂 | D. | 花生油 |
10.等质量的CH4和NH3相比较,下列结论错误的是( )
| A. | 二者的分子个数之比为17:16 | B. | 二者的原子个数之比为17:16 | ||
| C. | 二者的氢原子个数之比为17:12 | D. | 在相同条件下二者体积比为17:16 |
14.有机物  名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )
名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )
 名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )
名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )| A. | 其分子式为C10H15 | B. | 常温下它呈液态,难溶于水 | ||
| C. | 其一氯代物有8种 | D. | 能与溴水发生加成反应 |
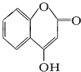 是用来制备抗凝血药的医药中间体,可通过下列路线合成:
是用来制备抗凝血药的医药中间体,可通过下列路线合成:
 .
. .
. 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色. .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究. 羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题:
羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题: .
.