题目内容
15.碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍.(1)A的分子式是C5H10O2;
(2)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团
①A的结构简式是
 ;
;②A不能发生的反应是(填写序号字母)b;
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(3)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是CH3COOCH(CH3)2+H2O
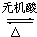 CH3COOH+(CH3)2CHOH.
CH3COOH+(CH3)2CHOH.
分析 有机物分子中N(H)=$\frac{102×9.8%}{1}$=10,故N(O)=$\frac{10}{5}$=2,N(C)=$\frac{102-10-16×2}{12}$=5,故该有机物的分子式为C5H10O2,一定条件下,A与一定氢气反应生成B,A含有不饱和键,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,故A为
,故A为 .
.
解答 解:(1)有机物分子中N(H)=$\frac{102×9.8%}{1}$=10,故N(O)=$\frac{10}{5}$=2,N(C)=$\frac{102-10-16×2}{12}$=5,故该有机物的分子式为C5H10O2,
故答案为:C5H10O2;
(2)①一定条件下,A与一定氢气反应生成B,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,则A为
,则A为 ,
,
故答案为: ;
;
②A中含有-CHO,能发生还原反应,含有-OH,能发生取代、酯化反应,由于相邻C原子上没有H原子,则不能发生消去反应,故答案为:b.
(3)A( )还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,则为乙酸与丙醇,其中一种的分子中有2个甲基,则为2-丙醇,A的同分异构体为CH3COOCH(CH3)2,此反应的化学方程式是:CH3COOCH(CH3)2+H2O
)还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,则为乙酸与丙醇,其中一种的分子中有2个甲基,则为2-丙醇,A的同分异构体为CH3COOCH(CH3)2,此反应的化学方程式是:CH3COOCH(CH3)2+H2O 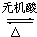 CH3COOH+(CH3)2CHOH,
CH3COOH+(CH3)2CHOH,
故答案为:CH3COOCH(CH3)2+H2O 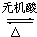 CH3COOH+(CH3)2CHOH.
CH3COOH+(CH3)2CHOH.
点评 本题考查有机物的推断、有机物官能团的结构和性质、限制条件同分异构体书写等,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查,难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
5.甲烷中混有乙烯,欲除去乙烯得到纯净干燥的甲烷,最好依次通过盛有哪项试剂的洗气瓶( )
| A. | 溴水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 澄清石灰水,浓H2SO4 | D. | 浓H2SO4,溴水 |
6.下列关于苯的叙述正确的是( )


| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应③为取代反应,有机产物是一种烃 | |
| C. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
20.下列关于有机物结构、性质的叙述正确的是( )
| A. | 丙烯与环丁烷互为同系物 | |
| B. | 碳氢化合物中的化学键都是极性键 | |
| C. | 乙醇与金属钠反应时,乙醇分子中的C-H键断裂 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
18.锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族.
(1)碱性:Sr(OH)2<Ba(OH)2(填“>”或“<”);用原子结构的观点解释其原因是同一主族元素,原子最外层电子数相同,原子核外电子层数逐渐增大,原子半径逐渐增大,原子失去电子的能力逐渐增强.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
①Ⅰ中,反应的化学方程式是SrSO4+Na2CO3=SrCO3+Na2SO4 .
②Ⅱ中,能与盐酸反应溶解的物质有BaSO4和SiO2.
③Ⅳ的目的是将Fe2+氧化为Fe3+,同时可以使Fe 3+和Al 3+沉淀完全.
④下列关于该工艺流程的说法正确的是ab.
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率.
(1)碱性:Sr(OH)2<Ba(OH)2(填“>”或“<”);用原子结构的观点解释其原因是同一主族元素,原子最外层电子数相同,原子核外电子层数逐渐增大,原子半径逐渐增大,原子失去电子的能力逐渐增强.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3.
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
②Ⅱ中,能与盐酸反应溶解的物质有BaSO4和SiO2.
③Ⅳ的目的是将Fe2+氧化为Fe3+,同时可以使Fe 3+和Al 3+沉淀完全.
④下列关于该工艺流程的说法正确的是ab.
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率.

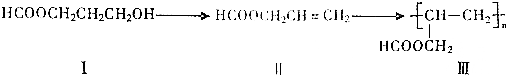
 .
.