题目内容
【题目】X、Y、Z、W四种短周期元素在周期表中的位置关系如图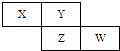
(1)Ⅰ若Z元素原子的最外层电子数是电子层数的2倍①W在周期表中的位置为 .
②Y和Z元素可组成的化合物的化学式为 .
③写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 .
④W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式 .
(2)Ⅱ若Y和Z的核外电子数之和为22①Y的气态氢化物电子式为 , 工业合成该物质的化学方程式为 .
②将X的最高价氧化物通入到苯酚钠溶液中,实验现象是 .
③X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4mol时,产生气体体积(标准状况下)是 .
【答案】
(1)第三周期ⅦA族;SO2、SO3;3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;4HClO4 ![]() 2Cl2↑+7O2↑+2H2O
2Cl2↑+7O2↑+2H2O
(2) ;N2+3H2
;N2+3H2 ![]() 2NH3;溶液变浑浊;6.72L
2NH3;溶液变浑浊;6.72L
【解析】解:X、Y、Z、W四种短周期元素,由元素在周期表的位置关系可知,X、Y处于第二周期,Z、W处于第三周期,(1)Ⅰ、若Z元素原子的最外层电子数是电子层数的2倍,则Z最外层电子数为6,故Z为硫元素,由元素在周期表中的相对位置可知,X为氮元素、Y为氧元素、W为Cl元素;①W为Cl元素,原子核外电子数为3,有3个电子层,最外层电子数为7,故处于周期表第三周期ⅦA族,
所以答案是:第三周期ⅦA族;
②氧元素与硫元素组成的化合物为:SO2、SO3 ,
所以答案是:SO2、SO3;
③铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O,
所以答案是:3Cu+2NO3﹣+8H+=3Cu2++2NO↑+4H2O;
④高氯酸浓溶液不稳定,受热可分解,产物之一是黄绿色气体,该气体为氯气,根据电子转移守恒可知,氧元素被氧化生成氧气,由氢元素守恒,还原水生成,当有28mol电子转移时,得到氯气为 ![]() =2mol,生成氧气为9mol﹣2mol=7mol,故反应方程式为:4HClO4
=2mol,生成氧气为9mol﹣2mol=7mol,故反应方程式为:4HClO4 ![]() 2Cl2↑+7O2↑+2H2O,
2Cl2↑+7O2↑+2H2O,
所以答案是:4HClO4 ![]() 2Cl2↑+7O2↑+2H2O;(2)Ⅱ、若Y和Z的核外电子数之和为22,令Y的核外电子数为y,则Z的核外电子数为y+8,则y+y+8=22,解得y=7,故Y为氮元素、Z为磷元素,则X为碳元素、W为硫元素;
2Cl2↑+7O2↑+2H2O;(2)Ⅱ、若Y和Z的核外电子数之和为22,令Y的核外电子数为y,则Z的核外电子数为y+8,则y+y+8=22,解得y=7,故Y为氮元素、Z为磷元素,则X为碳元素、W为硫元素;
①氨气分子中N原子成3个N﹣H键,N原子还原1对孤对电子,故氨气分子的电子式为  ,工业合成氨气的化学方程式为N2+3H2
,工业合成氨气的化学方程式为N2+3H2 ![]() 2NH3 ,
2NH3 ,
所以答案是:  ;N2+3H2
;N2+3H2 ![]() 2NH3;
2NH3;
②碳酸的酸性比苯酚强,反应生成苯酚,通常条件下苯酚溶解性不大,溶液变浑浊,
所以答案是:溶液变浑浊;
③碳与浓硫酸反应生成二氧化碳、二氧化硫,当电子转移0.4mol时,n(SO2)= ![]() =0.2mol、n(CO2)=
=0.2mol、n(CO2)= ![]() =0.1mol,故标准状况下产生气体的体积为(0.2mol+0.1mol)×22.4L/mol=6.72L,
=0.1mol,故标准状况下产生气体的体积为(0.2mol+0.1mol)×22.4L/mol=6.72L,
所以答案是:6.72L.



