题目内容
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为 。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ/mol。
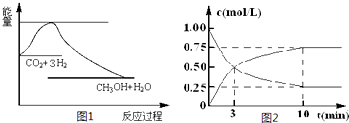
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
(1)CH3OH(l)+ O 2(g)=CO2(g)+2H2O(l)
△H=-726.6kJ/mol ( 3分)
O 2(g)=CO2(g)+2H2O(l)
△H=-726.6kJ/mol ( 3分)
(其中化学方程式完全正确 给2分、 △H=-726.6 J/mol 给1分)
(2)① ( 2分)
( 2分)
②0.075 mol·(L·min)-1 ( 2分,计算结果1分、单位1分);75% (2分)
③C (3分) ④ BD (4分,全对得4分,选一个对得2分,其它错误不得分)
【解析】
试题分析:(1)由m/M可知,n(CH3OH)=1/2mol,则1/2 CH3OH (l)+3/4O2(g)==1/2CO2(g)+H2O(l)
△H=—363.3kJ/mol,系数加倍可得,CH3OH(l)+ O 2(g)=CO2(g)+2H2O(l)
△H=-726.6kJ/mol;(2)①K=
O 2(g)=CO2(g)+2H2O(l)
△H=-726.6kJ/mol;(2)①K= ;②读图可知,v(CH3OH)=
;②读图可知,v(CH3OH)= =0.075mol•L—1•min—1;由于v(H2)=3 v(CH3OH)= 0.225mol•L—1•min—1,则△n(H2)= 0.225mol•L—1•min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
=0.075mol•L—1•min—1;由于v(H2)=3 v(CH3OH)= 0.225mol•L—1•min—1,则△n(H2)= 0.225mol•L—1•min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
考点:本题考查热化学方程式、化学反应速率和化学平衡。