题目内容
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶A和盛有潮湿有色布条的广口瓶B,可观察到的现象是_________; 设计实验 A 的目的是_____;写出氯气与水反应的化学方程式:___________。

(2)在该实验中,装置还存缺陷,你认为还需加_____装置才能使实验符合要求,写出其反应的化学方程式_____。
(3)根据(2)中反应原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,化学反应方 程式为:_____。漂白粉溶于水后,受空气中的 CO2 作用, 即产生有漂白、杀菌作用的物质,化学反应方程式为:_____。
【答案】干燥的有色布条不褪色,而潮湿的有色布条褪色干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性Cl2+H2O=HCl+HClO尾气吸收Cl2+2NaOH=NaCl+NaClO+H2O2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2OCa(ClO)2+H2O+CO2=CaCO3↓+2HClO
【解析】
(1)干燥的有色布条不褪色,而潮湿的褪色;氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;氯气和水反应生成盐酸和次氯酸;
(2)从实验安全角度分析,缺少尾气吸收装置,利用氯气和氢氧化钠溶液反应来处理尾气;
(3)氯气和氢氧化钙溶液反应生成氯化钙、次氯酸钙和水;漂白粉的有效成分是Ca(ClO)2,漂白粉溶于水后,受空气中的CO2作用,生成碳酸钙和次氯酸,以此来解答。
(1)氯气无漂白性,干燥的有色布条无明显现象,氯气与水反应Cl2+H2O=HCl+HClO生成的次氯酸具有漂白性,所以可观察到潮湿有色布条的广口瓶的现象是有色布条褪色,设计实验A的目的是:干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性,
因此,本题正确答案是:干燥的有色布条不褪色,而潮湿的有色布条褪色;干燥的氯气无漂白性,氯气和水反应生成的次氯酸具有漂白性;Cl2+H2O=HCl+HClO;
(2)氯气有毒,不能排放到空气中,因此装置中还需加用NaOH溶液吸收尾气的装置,氯气与NaOH溶液发生反应为Cl2+2NaOH=NaCl+NaClO+H2O,
因此,本题正确答案是:尾气吸收;Cl2+2NaOH=NaCl+NaClO+H2O;
(3)氯气和氢氧化钙反应2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,漂白粉的有效成分是Ca(ClO)2,次氯酸钙和二氧化碳反应Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,
因此,本题正确答案是:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O; Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO。

【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
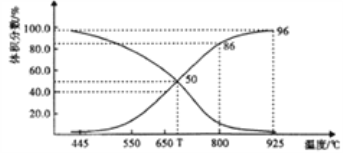
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2=S4O62-+2I-
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)按如图所示组装好装置后,应先_______________(填操作名称),再按图示加入试剂。仪器B和D的作用是____________________________;E中的试剂是__________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为______________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择):
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)用I2的标准溶液测定产品的纯度
取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除__________及二氧化碳。取10.00mL溶液。以________溶液为指示剂,用浓度为0.10mol/LI2的标准溶波进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________________________。Na2S2O3·5H2O在产品中的质量分数是_______________(用百分数表示,且保留1位小数)。
