题目内容
1.化学在生产和日常生活中有着重要的应用,下列叙述正确的是( )| A. | 土壤胶体带负电荷,有利于铵态氮肥的吸收 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
分析 A.土壤胶体带负电荷,可吸收阳离子;
B.钢缆为金属材料;
C.SiCl4水解生成HCl;
D.温室效应与二氧化碳有关.
解答 解:A.土壤胶体带负电荷,铵根离子带正电荷,可吸收阳离子,有利于吸收,故A正确;
B.钢缆为金属材料,含有铁,故B错误;
C.SiCl4水解生成HCl,HCl易溶于水,形成白雾,而不是烟,故C错误;
D.温室效应与二氧化碳有关,与二氧化氮无关,故D错误.
故选A.
点评 本题考查化学与生活,为高考常见题型,侧重于化学与生活、生产的考查,题目注重环境保护与污染的处理,明确化学与生活的联系及性质决定用途是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | A与C形成的化合物溶于水所得溶液显碱性 | |
| B. | B与D形成的化合物溶于水所得溶液显酸性 | |
| C. | 氢化物的稳定性:C>D | |
| D. | 简单离子的半径:B>C>D>A |
3.在Ag+催化作用下,Cr3+被S2O82-氧化为Cr2O72-的机理为:S2O82-+2Ag+=2SO42-+2Ag2+ 慢2Cr3++6Ag2++7H2O=6Ag++14H++Cr2O72-快下列有关说法正确的是( )
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
9.类比是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3)2.某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2,为验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分.探究过程如下:
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
请填空:
(1)提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是FeCl3和FeCl2的混合物
(2)设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如表:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 溶液变红色 | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含FeCl2 |
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是D.
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.在A溶液中加入淀粉KI溶液,溶液变蓝色
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液中热蒸干并灼烧,得到FeCl3固体
(5)已知25℃时Ksp=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5 mL 2mol/L的盐酸(忽略加入盐酸体积).加入盐酸的目的是:抑制氯化铁水解.
16.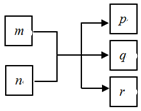 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )| A. | 简单离子半径的大小:Y<X<Z | |
| B. | X的简单氢化物的沸点在同族元素中最高 | |
| C. | Y分别与W、Z形成的两种化合物中化学键类型相同 | |
| D. | Z的氧化物对应的水化物为强酸 |
6.下列反应中硝酸既表现出了强氧化性又表现了酸性的是( )
| A. | 氧化铁与硝酸反应 | B. | 氢氧化铜与硝酸反应 | ||
| C. | 木炭粉与浓硝酸反应 | D. | 铜与硝酸反应 |
10.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 最外层电子数Li<Mg<Si<Ar |
11.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | “滴水石穿,绳锯木断”不包含化学变化 | |
| B. | “天宫一号”中使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 二氧化硅可用于光纤通信、单晶硅可用于光电转换 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物 |
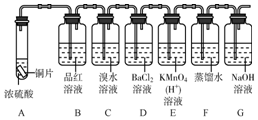 下面是某同学学习硫元素的学习方案.
下面是某同学学习硫元素的学习方案.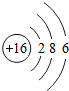 ,从结构知道硫元素是一种典型非金属元素.
,从结构知道硫元素是一种典型非金属元素.