题目内容
写出下列物质的电子式:①HCl: ;②NaCl: ;③NH3: ;④CaCl2: ;⑤Na2O2: ;⑥Cl2: .
考点:电子式
专题:化学用语专题
分析:首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
解答:
解:①HCl属于共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl电子式为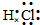 ,故答案为:
,故答案为: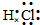 ;
;
②NaCl为离子化合物,由钠离子与氯离子构成,电子式为: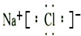 ,故答案为:
,故答案为: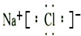 ;
;
③NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故答案为:
,故答案为: ;
;
④CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,故答案为:
,故答案为: ;
;
⑤Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
⑥Cl2分子中存在1个氯氯共用电子对,氯气分子的电子式为: ,故答案为:
,故答案为: .
.
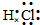 ,故答案为:
,故答案为: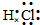 ;
;②NaCl为离子化合物,由钠离子与氯离子构成,电子式为:
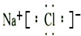 ,故答案为:
,故答案为: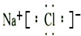 ;
;③NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为
 ,故答案为:
,故答案为: ;
;④CaCl2是离子化合物,由钙离子与氯离子构成,电子式为
 ,故答案为:
,故答案为: ;
;⑤Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
 ,故答案为:
,故答案为: ;
;⑥Cl2分子中存在1个氯氯共用电子对,氯气分子的电子式为:
 ,故答案为:
,故答案为: .
.
点评:本题考查学生电子式的书写知识,题目难度不大,结合物质的成键情况并根据电子式的书写规则解答.

练习册系列答案
相关题目
用石墨为电极材料电解时,下列说法正确的是( )
| A、电解NaOH溶液时,溶液浓度将减小,pH不变 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH不变 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH不变 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
 和
和 ; ②
; ② 和
和 ;
; 在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题: