题目内容
(15分)
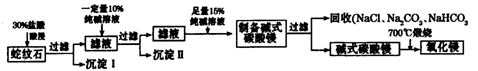
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
② 过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③ 除去Mg2+的离子方程式是______。
④ 检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是______。
③ 过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______。
(15分)
(1)SO42-
(2)① 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明
Fe 3+已除尽;反之没除尽
② BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
③ 2Mg2+ + 2CO32- + H2O ="=" Mg2(OH)2CO3↓+ CO2↑
④ 在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全
(3)① NH4+、I-
② 5S2O32- + 8IO3- + 2OH- ="=" 4I2 + 10SO42- + H2O
③ H+在阴极上得电子变成H2逸出,使H2O H+ +OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
H+ +OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成
解析试题分析:(1)BaCl2溶液与粗盐水中的SO42-离子反应生成硫酸钡沉淀,所以过程Ⅰ除去的离子是SO42-离子;
(2)①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe 3+已除尽;反之没除尽;
②从表中数据可知,BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
③ 溶液中的Mg2+与CO32-发生水解而生成沉淀,除去镁离子的离子方程式为2Mg2+ + 2CO32- + H2O ="=" Mg2(OH)2CO3↓+ CO2↑
④ 检测沉淀是否完全,只需检测溶解度较大的沉淀即可。在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全;
(3)①过程Ⅳ加入NaClO,有N2放出,说明过程Ⅳ除去的离子是NH4+;
②Na2S2O3将IO3- 还原为I2,本身被还原成SO42- +,离子方程式为 5S2O32- + 8IO3- + 2OH- ="=" 4I2 + 10SO42- + H2O;
③ H+在阴极上放电变成H2逸出,使H2O H+ +OH-电离平衡向右移动,使阴极区OH-离子浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。
H+ +OH-电离平衡向右移动,使阴极区OH-离子浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成。
考点:考查粗盐的精制,离子检验及除杂,沉淀完全的判断,电解原理的应用,离子方程式的书写

(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
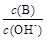 ②
② 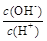 ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量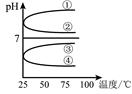
 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。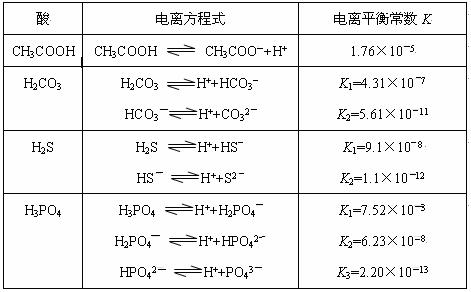
 Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
