题目内容
某实验者拟在实验室中用石灰石(主要成分是碳酸钙,属于弱酸盐)跟稀盐酸反应制取二氧化碳气体,化学反应的方程式为CaCO3+2HCl![]() CaCl2+CO2↑+H2O.结果实验室里暂时没有盐酸,需要用其他物质来代替盐酸.你认为可以选用的常见的物质是________(列举两种,写出其名称).简要地说明作出这种选择的理由是________________.
CaCl2+CO2↑+H2O.结果实验室里暂时没有盐酸,需要用其他物质来代替盐酸.你认为可以选用的常见的物质是________(列举两种,写出其名称).简要地说明作出这种选择的理由是________________.
解析:
答案:稀硝酸溶液、醋酸溶液 它们都是酸性比碳酸强的酸,并且易溶于水
解析:化学反应CaCO3+2HCl![]() CaCl2+CO2↑+H2O是强酸跟弱酸盐的反应.从物质属类及其性质规律的角度来看,可以选择其他的酸代替盐酸.酸又包括很多种,在上述化学反应中,盐酸是比碳酸酸性强且易溶于水的酸,应该从这一类酸中选择盐酸的替代者.可应用的酸有醋酸、硝酸等,其化学反应的方程式为:
CaCl2+CO2↑+H2O是强酸跟弱酸盐的反应.从物质属类及其性质规律的角度来看,可以选择其他的酸代替盐酸.酸又包括很多种,在上述化学反应中,盐酸是比碳酸酸性强且易溶于水的酸,应该从这一类酸中选择盐酸的替代者.可应用的酸有醋酸、硝酸等,其化学反应的方程式为:
CaCO3+2CH3COOH![]() Ca(CH3COO)2+CO2↑+H2O
Ca(CH3COO)2+CO2↑+H2O
CaCO3+2HNO3![]() Ca(NO3)2+CO2↑+H2O
Ca(NO3)2+CO2↑+H2O

 永乾教育寒假作业快乐假期延边人民出版社系列答案
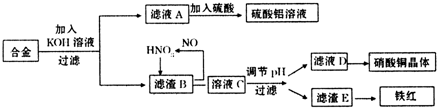
永乾教育寒假作业快乐假期延边人民出版社系列答案垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下: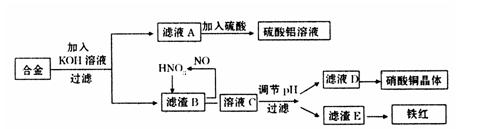
(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
。
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K2SO4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液。仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)
(3)已知Fe(OH)3沉淀的pH是2~3.2。溶液C通过调节pH可以使Fe3+沉淀完全。下列物
质中,可用作调整溶液C的pH的试剂是 (填序号)
| A.铜粉 | B.氨水 | C.氧化铜 | D.氢氧化铜 |
(填操作名称)、自然干燥。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1。将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是 ,被还原的n(HNO3)= 。