题目内容
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是( )
| A.X、Y、Z的稳定性逐渐减弱 |
| B.A、B、C、D只能形成5种单质 |
| C.X、Y、Z三种化合物的熔、沸点逐渐升高 |
| D.自然界中存在多种由A、B、C、D四种元素组成的化合物 |
A、B、C、D四种短周期元素的原子半径依次减小,A与C核电荷数之比为3:4的两元素有Li和Be、C和O、F和Mg、Mg和S,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.A为C元素,C为O元素,D为H元素,则B为N元素.X、Y、Z分别为CH4、NH3、H2O.
A、非金属性越强,氢化物越稳定,同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,所以CH4、NH3、H2O的稳定性逐渐增强,故A错误;
B、由于C元素有非常多的同素异形体金刚石、石墨、C60、C70、C100等,氧元素只存在O2、O3等,故B错误;
C、NH3分子间形成氢键比CH4分子间作用力大,沸点高,水常温是液体,沸点最高,所以X、Y、Z三种化合物的熔、沸点逐渐升高,故C正确;
D、四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物,故D正确.
故选:CD.
A、非金属性越强,氢化物越稳定,同周期随原子序数增大,非金属性增强,所以非金属性C<N<O,所以CH4、NH3、H2O的稳定性逐渐增强,故A错误;
B、由于C元素有非常多的同素异形体金刚石、石墨、C60、C70、C100等,氧元素只存在O2、O3等,故B错误;
C、NH3分子间形成氢键比CH4分子间作用力大,沸点高,水常温是液体,沸点最高,所以X、Y、Z三种化合物的熔、沸点逐渐升高,故C正确;
D、四元素组成的化合物除常见的碳酸铵、碳酸氢铵外,有机物中硝基化合物、硝酸酯、氨基酸、蛋白质等均属于C、H、O、N组成的化合物,故D正确.
故选:CD.

练习册系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

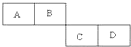 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.