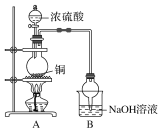
题目内容
【题目】工业上制取CuCl2的生产流程如下:
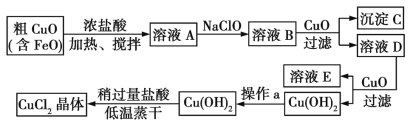
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是________________________。
(2)在溶液B中加入CuO的作用是________________________________。
(3)操作a的目的是__________________________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是________________。
【答案】将Fe2+氧化为Fe3+,使后续分离更加完全 调节溶液的pH为3~4,使Fe3+完全转化为Fe(OH)3沉淀 洗涤Cu(OH)2表面的可溶性杂质 抑制Cu2+的水解
【解析】
由生产流程可知,加入NaClO的目的是将Fe2+氧化为Fe3+,以便在后续的生产中被除去。溶液B呈酸性,Fe3+可溶,加入的CuO可以与酸反应,提高溶液的pH,当溶液的pH为3~4时,Fe3+就会以Fe(OH)3的形式沉淀出来。过滤除去氢氧化铁,此时再加入CuO,调节溶液pH,使铜离子沉淀为氢氧化铜,过滤、洗涤沉淀得到氢氧化铜。向氢氧化铜中加入盐酸溶解生成氯化铜溶液,CuCl2溶液在蒸发结晶过程中会发生水解反应:Cu2++2H2O![]() Cu(OH)2+2H+,加入盐酸和采用低温可抑制Cu2+水解,从而得到较高纯度的产品。
Cu(OH)2+2H+,加入盐酸和采用低温可抑制Cu2+水解,从而得到较高纯度的产品。
(1)根据表格中的溶度积可知,Fe3+比Fe2+更易水解形成Fe(OH)3沉淀,加入NaClO的目的是将Fe2+氧化为Fe3+,使后续分离更加完全;
(2)粗氧化铜采用浓盐酸浸渍,此时浸渍液为强酸性,加入的CuO可以与酸反应,提高溶液的pH,当溶液的pH为3~4时,Fe3+就会以Fe(OH)3的形式沉淀出来;
(3)过滤得到的Cu(OH)2表面有可溶性杂质,应以适量蒸馏水洗去;
(4)CuCl2溶液在蒸发结晶过程中铜离子会发生水解反应:Cu2++2H2O![]() Cu(OH)2+2H+,加入盐酸可抑制Cu2+水解,水解反应为吸热反应,采用低温抑制Cu2+水解,从而得到较高纯度的产品。
Cu(OH)2+2H+,加入盐酸可抑制Cu2+水解,水解反应为吸热反应,采用低温抑制Cu2+水解,从而得到较高纯度的产品。

 智能训练练测考系列答案
智能训练练测考系列答案