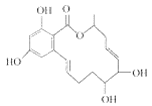
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol![]() 中含有的碳碳双键数为4NA
中含有的碳碳双键数为4NA
B.1 L 0.1mol/L NH4Cl溶液中含有NH![]() 的数目为0.1NA
的数目为0.1NA
C.6.2g白磷分子中含P-P键为0.2 NA
D.7.8gNa2O2和Na2S的固体混合物中含有的离子总数为0.3NA
【答案】D
【解析】
A.由于苯环中并无碳碳双键,故1 mol![]() 中含有的碳碳双键数为1NA,A错误;
中含有的碳碳双键数为1NA,A错误;
B.由于![]() 会发生水解,故1 L 0.1mol/L NH4Cl溶液中含有
会发生水解,故1 L 0.1mol/L NH4Cl溶液中含有![]() 的数目要小于0.1NA,B错误;
的数目要小于0.1NA,B错误;
C.6.2g白磷分子中含P-P键为![]() ,C错误;
,C错误;
D.Na2O2和Na2S的摩尔质量均为78g/mol,且Na2O2和Na2S都是由两个阳离子和一个阴离子组成的,故7.8gNa2O2和Na2S的固体混合物中含有的离子总数为![]() ,D正确;
,D正确;
故答案为:D。

【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q