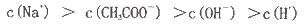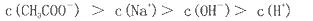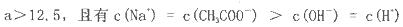题目内容
在固定容积的容器中盛有1molPCl5,200℃时发生如下反应:PCl5(g)?PCl3+Cl2(g)达到平衡时,PCl5体积分数为M%.若在同一温度和同一容器中,最初投入2molPCl5,达平衡时,PCl5所占体积分数为N%,则M和N的关系是( )
| A.M<N | B.M>N | C.M=N | D.无法比较 |
根据PV=nRT知,R为常数,当V、T相同时,n越大,P越大;该反应是气体体积增大的反应,当投入的物质的量加倍时,则相当于增大压强,平衡向气体体积减小的方向移动,即逆反应方向移动,所以导致反应达到平衡时PCl5的转化率减小,PCl5的体积分数增大,故M<N.
故选A.
故选A.

练习册系列答案
相关题目

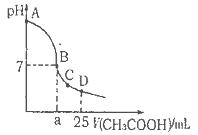
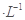 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol