题目内容
【题目】二氧化碳的有效回收利用,既能够缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。请回答下列问题:
(1)CO2的电子式为___________。
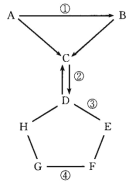
(2)Zn/ZnO热化学循环还原CO2制CO的原理如下图:
①从循环结果看,能量转化的主要方式是_________________________________。
②反应2CO2(g)=2 CO(g) +O2(g) △H=___________kJ·mol-1。
(3)二甲醚是重要的有机中间体,在一定条件下利用CO2与H2可直接合成二甲醚:
2CO2(g)+6H2(B)![]() CH3OCH3(g)+3H2O(g),当n(H2)/n(CO2)=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
CH3OCH3(g)+3H2O(g),当n(H2)/n(CO2)=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
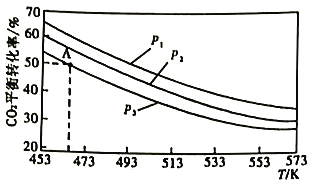
①该反应的△H___________0(填“>”或“<")。
②上图中的压强(p)由大到小的顺序为___________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应上图中的A点,则在此温度下,该反应的化学平衡常数为___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。
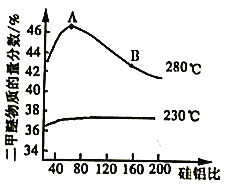
图中A点和B点的化学平衡常数比较:KA___________KB(填“>、=、<")。根据以上两条曲线,写出其中一条变化规律:____________________________________________。
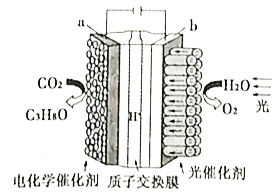
(4)利用电化学原理将H2O和CO2转化为O2和燃料(C3H8O)的实验装置如下图所示。a电极的电极反应式为_________________________________。
 .
.
【答案】![]() 太阳能转化为化学能 564 < p1>p2>p3 23 = a.温度越高,二甲醚的选择性(或物质的量分数)越大;b.低温时硅铝比对二甲醚的选择性(或物质的量分数)影响不大,高温时随着硅铝比增大,二甲醚的选择性(或物质的量分数)先增大后减小。 3CO2+18H++18e-=C3H8O+5H2O
太阳能转化为化学能 564 < p1>p2>p3 23 = a.温度越高,二甲醚的选择性(或物质的量分数)越大;b.低温时硅铝比对二甲醚的选择性(或物质的量分数)影响不大,高温时随着硅铝比增大,二甲醚的选择性(或物质的量分数)先增大后减小。 3CO2+18H++18e-=C3H8O+5H2O
【解析】
(1)可以根据价键规则书写CO2的电子式,注意检查是否满足8电子稳定结构;
(2)仔细分析图像可知在太阳能的作用下实现了反应2CO2(g)= 2CO(g)+O2(g),再利用盖斯定律进行计算;
(3)①依据图像,随温度升高,CO的转化率降低确定反应为放热反应;
②2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)正反应为气体分子数减小的反应,温度一定时,压强越大,CO2的转化率越大;
CH3OCH3(g)+3H2O(g)正反应为气体分子数减小的反应,温度一定时,压强越大,CO2的转化率越大;
③根据A点,利用三段式法计算平衡常数;
④平衡常数只受温度影响,图中280℃下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230℃的曲线变化相对平缓,280℃的曲线变化程度较大且先升后降,280℃二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变;
(4)a与电源负极相连,所以a是阴极,CO2发生还原反应生成C3H8O,据此书写电极反应式。
(1)根据价键规则,CO2的电子式为![]() ;
;
正确答案:![]() 。
。
(2)仔细分析图像可知在太阳能的作用下实现了反应2CO2(g)= 2 CO(g) +O2(g),所以实现了太阳能向化学能转化;利用盖斯定律进行计算将已知两个热化学方程式相加后再乘以2即得2CO2(g)= 2 CO(g) +O2(g) △H=564kJ/mol;
正确答案:太阳能转化为化学能 564。
(3) ①依据图像,随温度升高,CO的转化率降低,确定反应为放热反应,ΔH<0;
正确答案:<。
②2CO2(g)+6H2(B)![]() CH3OCH3(g)+3H2O(g)正反应为气体分子数减小的反应,温度一定时,压强越大,CO2的转化率越大,根据图像温度相同时CO2的转化率:p1>p2>p3,则图中压强由大到小的顺序为p1>p2>p3;
CH3OCH3(g)+3H2O(g)正反应为气体分子数减小的反应,温度一定时,压强越大,CO2的转化率越大,根据图像温度相同时CO2的转化率:p1>p2>p3,则图中压强由大到小的顺序为p1>p2>p3;
正确答案:p1>p2>p3。
③根据A点,利用三段式法计算平衡常数;
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始量(mol/L)0.2 0.6 0 0
反应量(mol/L)0.1 0.3 0.05 0.15
平衡梁(mol/L)0.1 0.3 0.05 0.15
K=![]() ≈23;
≈23;
正确答案:23。
④平衡常数只受温度影响,图中280℃下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230℃的曲线变化相对平缓,280℃的曲线变化程度较大且先升后降,280℃二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,故可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;
正确答案:a.温度越高,二甲醚的选择性(或物质的量分数)越大;b.低温时硅铝比对二甲醚的选择性(或物质的量分数)影响不大,高温时随着硅铝比增大,二甲醚的选择性(或物质的量分数)先增大后减小。
(4)a与电源负极相连,所以a是阴极,CO2发生还原反应生成C3H8O,电极反应式为3CO2+18H++18e-=C3H8O+5H2O;
正确答案:3CO2+18H++18e-=C3H8O+5H2O。

【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用做供氧剂。
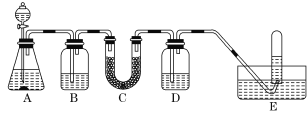
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:______。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
C | Na2O2 | _______ |
D | NaOH溶液 | _______ |
(3)写出Na2O2与CO2反应的化学方程式:______。
(4)试管中收集满气体后,下一步实验操作及现象、结论是___。