题目内容
13.已知0.1mol/L的醋酸溶液存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )| A. | c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 | |
| C. | 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 | |
| D. | 加入少量CH3COONa固体,电离平衡不移动,溶液导电性减弱 |
分析 A.任何电解质溶液中都存在物料守恒,且醋酸是弱电解质,在水溶液中存在电离平衡;
B.HCl是强电解质,在水溶液中完全电离,所以相同浓度的HCl和醋酸溶液,HCl中c(H+)大于醋酸,向0.1mol/L的醋酸中加入0.1mol/LHCl溶液,溶液中c(H+)增大,抑制醋酸电离;
C.NaOH和H+反应生成水,促进醋酸电离;溶液导电性与离子浓度成正比;
D.加入少量CH3COONa固体,抑制醋酸电离;溶液导电性与离子浓度成正比.
解答 解:A.根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.1mol/L,所以溶液中c(H+)+c(CH3COO-)+c(CH3COOH)>0.1mol/L,故A错误;
B.HCl是强电解质,在水溶液中完全电离,所以相同浓度的HCl和醋酸溶液,HCl中c(H+)大于醋酸,向0.1mol/L的醋酸中加入0.1mol/LHCl溶液,溶液中c(H+)增大,抑制醋酸电离,平衡逆向移动,故B错误;
C.NaOH和H+反应生成水,促进醋酸电离,平衡正向移动;溶液导电性与离子浓度成正比,溶液中离子浓度增大,所以溶液导电性增强,故C正确;
D.加入少量CH3COONa固体,醋酸根离子浓度增大,从而抑制醋酸电离,平衡逆向移动;溶液导电性与离子浓度成正比,溶液中离子浓度增大,导电性增强,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及电离影响因素是解本题关键,注意溶液导电性强弱与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
3.苯分子中的碳碳键不是单双键交替的,不能作出这种判断的证据是( )
| A. | 苯的邻位二元取代物只有一种 | B. | 苯环中碳碳键均相同 | ||
| C. | 苯的一元取代物无同分异构体 | D. | 苯不使酸性KMnO4溶液褪色 |
4.下列说法正确的是( )
| A. | 在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 | |
| B. | 氧化剂在反应中被氧化,还原剂在反应中被还原 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 物质中若含有处于中间价态的元素,则该物质可能既具有氧化性又具有还原性 |
1.下列不能表明醋酸是弱电解质的是( )
| A. | 0.1mol/L的醋酸水溶液的pH值为3 | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使石蕊变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
8.某高聚物可表示为图所示,则下列叙述不正确的是( )
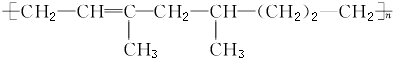
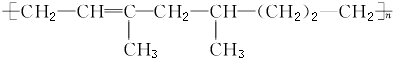
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |
18.下列说法正确的是( )
| A. | 氯水、氨水和食盐水都能导电,所以Cl2、NH3和NaCl都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向右移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
5.下列有机反应中,有一种反应类型与其他三种反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 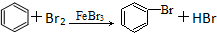 |
2.下列实验操作中正确的是( )
| A. | 蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏石油时,应使温度计水银球插入液面以下 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 | |
| D. | 检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液 |