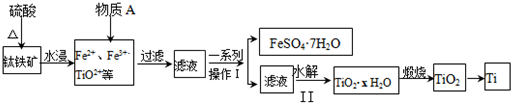
题目内容
7.1,2-二溴乙烷可作汽油抗爆剂的添加剂,如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).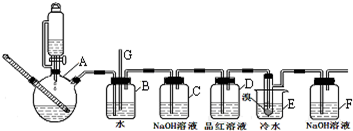
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)实验开始之前必要的操作是检查装置的气密性.
(2)仪器A的名称为CH3CH2OH$→_{℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸(答出其中两条即可).
分析 实验室制备1,2-二溴乙烷流程:装置A中:乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,安全瓶B可以防止倒吸;当堵塞时,气体不畅通,则在B中气体产生的压强将水压入直玻璃管G中,甚至溢出玻璃管,装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化硫发生反应,除去乙烯中带出的酸性气体,装置D中品红溶液验证二氧化硫是否被除尽,液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,E装置中:乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用F吸收,
(1)因反应过程中有气体参与,所以实验开始之前必要的操作是检查装置的气密性;
(2)装置A中的反应为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯;
(3)如果B中压强增大,玻璃管中液面会上升,应停止加热,向烧杯E中加适量温水
(4)二氧化硫能使品红褪色;
(5)液溴易挥发,冷水冷却,能减少液溴挥发;由表中数据可知温度太低,1,2-二溴乙烷会凝结为固体;
(6)液溴为红棕色,产物1,2-二溴乙烷为无色,根据颜色变化判断反应是否结束;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发.
解答 解:(1)因反应过程中有气体参与,所以实验开始之前必要的操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)装置A中的反应为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,反应方程式为CH3CH2OH$→_{℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{℃}^{浓硫酸}$CH2=CH2↑+H2O;
(3)如果B中压强增大,玻璃管G中液面会上升,可能产生乙烯的速率过快,导致E装置内乙烯和溴单质来不及完全反应逸出,导致压强增大,所以实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是:停止加热减慢乙烯产生速率,向烧杯E中加适量温水提高E中反应速率,
故答案为:停止加热,向烧杯E中加适量温水;
(4)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全,
故答案为:验证二氧化硫是否被除尽;
(5)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发,
故答案为:减少液溴挥发;
(6)液溴为红棕色,产物1,2-二溴乙烷为无色,当反应结束时液溴全部转化为1,2-二溴乙烷,E中液体由红棕色变为无色;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发,会导致无水乙醇消耗量大大超过理论值,
故答案为:装置E中小试管内的液体由红棕色变为无色;有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出.
点评 本题考查有机物1,2-二溴乙烷的制取实验设计,解答本题的关键是把握制备实验的原理,牢固把握实验基本操作以及除杂问题是解答该类题目的保证,题目难度中等.

| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热△H=-571.6 kJ•mol-1 | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)═2H2O2(l)△H1=+108.3 kJ•mol-1 ① N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.0 kJ•mol-1 ② 则有反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-642.3 kJ•mol-1 | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
FeSO4$\underset{\stackrel{\;}{→}}{①}$FeOOH$\underset{\stackrel{\;}{→}}{②}$Fe2O3$\underset{\stackrel{\;}{→}}{③}$Fe3O4$\underset{\stackrel{CuS{O}_{4}溶液④}{→}}{\;}$CoxFe3-xO4
回答下列问题:
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH.生成FeOOH的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O.
(2)步骤②将FeOOH在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤③通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为除去空气,防止氢气与氧气混合反应爆炸.
(4)步骤④加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品是否洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;后发现滤液浑浊,请写出原因(一点即可)玻璃棒抵住滤纸时滤纸破裂、原液液面高于滤纸边缘.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的+2价和+3价的氧化物)制备CoSO4•7H2O晶体.已知在酸性条件下不稳定极易变成两价钴离子,下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、冷却结晶(填实验步骤),得到CoSO4•7H2O晶体.若欲再提纯,可以通过重结晶(填实验步骤).
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+$\frac{3}{2}$O2(g)=CO(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 中和热测定实验中的终止温度就是实验过程中混合液的最高温度 | |
| C. | 为了减少大气中的雾霾,天然气日渐成为一种备受关注的可再生的清洁能源 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
(2)将50mL该浓硫酸与200mL水均匀混合,所得稀硫酸的质量分数是多少?
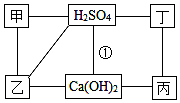 如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.
如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.